2022年已经过去,在过去的一年中,全球创新药物井喷式上市。仅美国FDA就批准了数十款创新药物及疗法。虽与2021年数据相比较,2022年FDA的审批标准趋严,在FDA反内卷背景下获批新药数量有所下降,但仍有多项创新药物获批,据不完全统计2022年“First-in-Class”疗法比例也相较过去多年数据中居于高位。
除了一般意义上的靶向药物和免疫抑制剂外,如CAR-T这样的细胞疗法也渐露头角,多款细胞疗法产品在美国获批上市。其中,国产CAR-T先锋传奇生物也位列其中,成为了2022年为数不多成功登陆美国市场的国产创新药物/疗法。
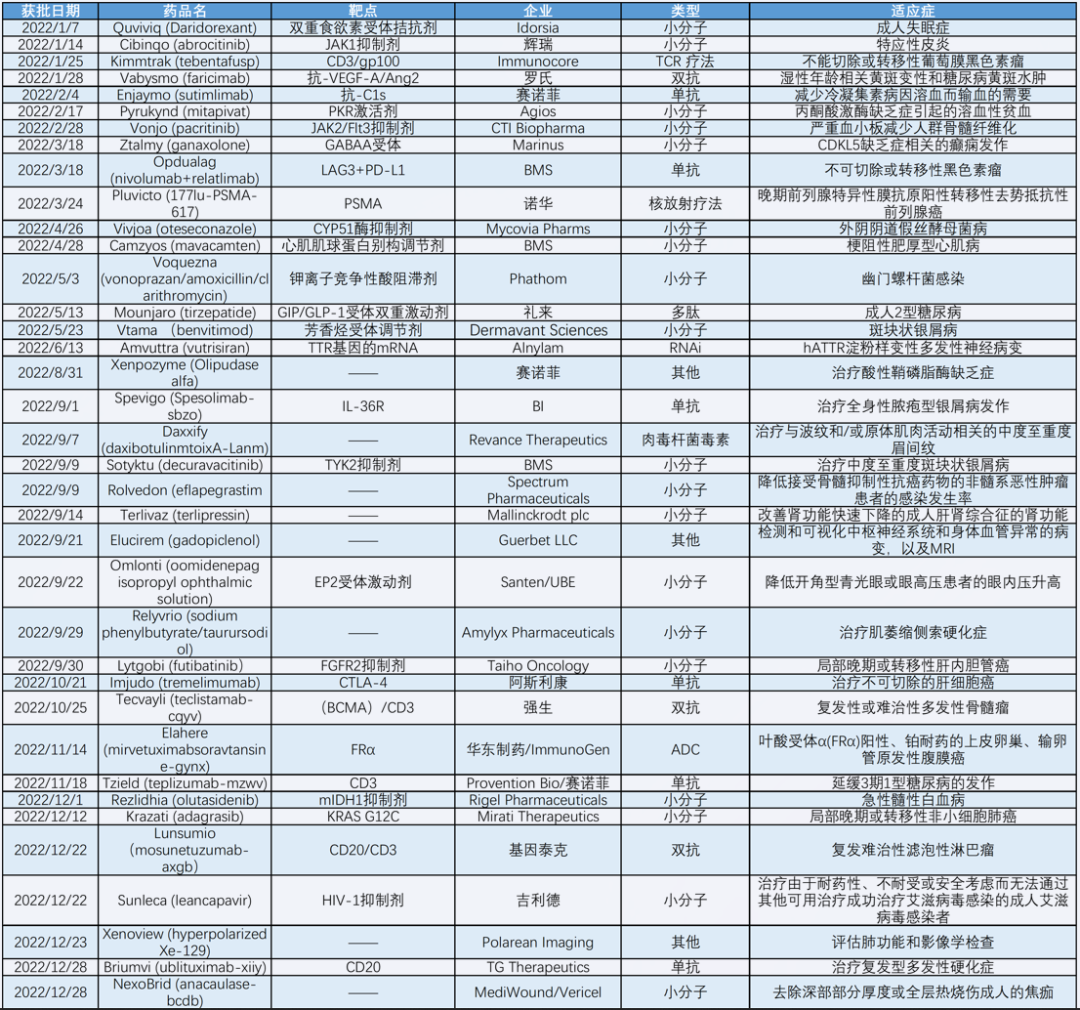
根据《医药经济报》新媒体中心的不完全统计结果显示,2022年美国FDA批准的创新药物有37种,其中获批小分子药物仍占的突破性/创新的药物或疗法的大头,约有19款小分子药物,占比超过五成,其次为单抗类药物,占比接近约16%。
9月份则是2022年间,FDA批准新药速度爆发的一个月。该月,FDA就批准了9款,治疗范围包括银屑病、除皱、肾功能、ALS、胆管癌等药物上市,约占比全年获批新药数量的24.3%。
值得一提的是,2022年除了上述获批药物以外,还有4款基因疗法获批上市。其中3款基因疗法药物在2022年三度刷新全球最贵药物历史记录,引发热议。
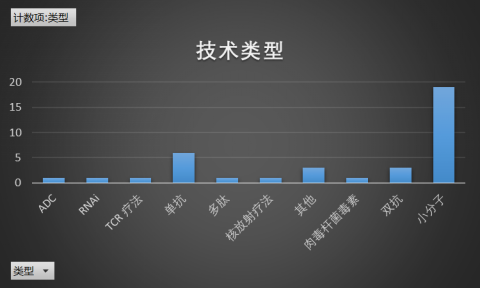
据不完全统计,美国FDA的药物评估和研究中心(CDER)在2022年批准上市的数十款创新型药物/疗法中约有19款“First-in-Class”药物,表现远不及2021年的27款FIC记录,但整体表现也算位于近8年来中位数水准。
获批新药仅为众多研发热点中的一小部分,还有众多的新药研发,创新技术仍在路上。让我们期待2023,期望能见证更多创新疗法获批,满足未被满足的临床需求,为全球病患带来新的治疗方案。
现在,让我们来看看部分引发关注的创新产品吧!
1月25日,FDA批准由Immunocore开发的首款治疗不可切除或转移性葡萄膜黑色素瘤疗法Kimmtrak(tebentafusp-tebn)。据悉,这也是首款获得监管批准的T细胞受体(TCR)疗法,及首款获FDA批准的治疗实体肿瘤的双特异性T细胞接头。
1月28日,FDA批准了罗氏用于治疗湿性年龄相关黄斑变性和糖尿病黄斑水肿的抗VEGF-A/Ang2双抗药物Vabsmo(Faricimab)。
2月4日,FDA批准了赛诺菲针对经典补体途径中C1s蛋白的单抗Enjaymo(sutimlimab)上市,该产品是首款FDA批准用于冷凝集素病患者的疗法,它能够抑制患者因为补体蛋白激活导致的溶血。
2月17日,FDA批准Agios公司Pyrukynd (mitapivat)上市,据悉,Pyrukynd是首个用于治疗丙酮酸激酶缺乏症引起的溶血性贫血的修饰疗法。
2月28日,美国CTI BioPharma Corp.宣布FDA批准旗下VONJO (pacritinib) 用于治疗患有中度或高危原发性的成人或继发性(真性红细胞增多症或原发性血小板增多症后)骨髓纤维化。
3月18日,FDA批准首款治疗细胞周期蛋白依赖性激酶样5(CDKL5)缺乏症(CDD)相关的癫痫发作药物Ztalmy(ganaxolone,加奈索酮)。
3月18日,BMS宣布批准Opdualag(relatlimab+nivolumab, LAG-3+PD-1)固定剂量复方组合的上市申请,用于治疗成人和12岁以上青少年(体重≥40kg)的不可手术切除或转移性黑色素瘤。据悉,relatlimab是继CTLA-4、PD-1/PD-L1之后,全球批准的第3类免疫检查点抑制剂。BMS也是目前首家同时上市3种不同免疫检查点抑制剂的公司。
3月24日,诺华宣布,美国FDA已经批准该公司的靶向放射性配体疗法Pluvicto(lutetium Lu 177 vipivotide tetraxetan)上市用于治疗前列腺特异性膜抗原(PSMA)阳性转移性去势抵抗性前列腺癌(mCRPC)患者,这些患者先前已经接受过基于紫杉烷的化疗和雄激素受体信号通路抑制剂治疗。
4月26日,FDA批准Mycovia公司开发的新型口服抗真菌药物Vivjoa(oteseconazole),用于在不具有生殖潜力的女性中,降低复发性外阴阴道假丝酵母菌病(RVVC)的复发几率。这是FDA批准的首个治疗RVVC的药物。恒瑞医药已引进该药物并于今年1月在国内提交了新药上市申请
4月28日,百时美施贵宝(BMS)的mavacamten获FDA批准上市,用于治疗根据纽约心脏协会功能等级(NYHA)评级为II-III级的梗阻性肥厚型心肌病(oHCM)成人患者,以改善运动能力和症状。该产品已于今年2月获CDE突破性疗法认定。

5月13日,礼来宣布,美国FDA批准该公司葡萄糖依赖性促胰岛素多肽(GIP)和胰高血糖素样肽-1(GLP-1)受体双重激动剂Mounjaro(tirzepatide) 上市。据悉,此款药物只需每周一次并辅以饮食控制和运动,即可改善成人2型糖尿病患者的血糖控制,极大改善患者用药便利性和控糖长效性。而礼来方面表示,Mounjaro代表着近10年来,首个新糖尿病药物类型。
5月23日,Dermavant Sciences宣布FDA已批准VTAMA(tapinarof,1%,中文名:本维莫德)乳膏上市,用于成人斑块型银屑病的局部治疗。据悉,该款产品是FDA批准的同类中首个也是唯一一个无类固醇的外用药物,同时也是美国25年来获批治疗银屑病的首款外用新分子实体药物。这也是本土企业天济医药研发、具有自主知识产权的(first-in-class)全球创新药。
6月13日,美国FDA批准了用于治疗遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病(hATTR-PN)成人患者的药物Amvuttra (vutrisiran)。据悉,负责此款药物研发的是一家业内领先的RNAi治疗公司Alnylam。值得一提的是,此款药物是第一款也是目前唯一一款3个月皮下注射一次治疗显示逆转神经病变损害的疗法。
10月21日,FDA批准了阿斯利康的CTLA-4抑制剂Imjudo (tremelimumab)联合PD-L1抑制剂Imfinzi (durvalumab, 中文名:英飞凡)用于一线治疗不可切除的肝细胞癌患者。据悉,这也是首款成功获批用于肝癌一线治疗的免疫疗法。
11月18日,FDA宣布批准Provention Bio公司的CD3单克隆抗体teplizumab上市,用于延缓成人3期1型糖尿病和8岁及以上儿童2期1型糖尿病的疾病进程。据悉,这是迄今为止唯一一款能延缓1型糖尿病发作的药物。
11月30日,FDA批准由Rebiotix开发的基于微生物群的活体生物治疗药物Rebyota,这事FDA批准的首款粪便微生物群产品,用于预防18岁以上艰难梭菌感染(CDI)成人患者感染复发。有业内人士称,这是一款让需要患者最尴尬的药物:药物需要由合格人员捐赠的粪便制成,再通过直肠给药。
12月22日,吉利德发文宣布,FDA已批准Sunleca (Lenacapaivr)上市。据悉,此款药物联合其他抗逆转录病毒,疗有多重耐药、多次治疗经验的成人HIV-1感染。这也是目前全球唯一一款获批上市的每年仅需给药2次的HIV治疗药物。极大的提高了HIV患者的用药便利性。
12月28日,FDA批准了TG Therapeutics的成人多发性硬化症治疗药物 Briumvi(ublituximab),该产品为CD20定向抗体。据悉,此款药物可用于用于治疗某些复发型多发性硬化症(RMS),包括成人的临床孤立综合征、复发缓解型疾病和活动性继发性进展性疾病。目前,全球有超过230万人被诊断为多发性硬化。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx