礼来在前不久发布的第三季度的证券备案文件中表示,终止了Tyvyt(Sintilimab, 信迪利单抗)在中国以外地区的协议,并将该药重新交给信达生物。“礼来宣布正式放弃与信达生物关于PD-1产品Tyvyt合作”的消息,近日得到媒体披露。
作为中国国产创新药研发和国际化的代表产品之一,信迪利单抗的产品进展,一直以来吸引着业内巨大的关注和大型制药公司兴趣。同时,礼来第三季度报上也明确提到,信迪利单抗也是公司产品增长的重要组成部分。

市场观点认为,随着创新药细分领域扎堆“内卷”,国内PD-1价格天花板被不断拉低,海外市场已经成为国产新药的机会与希望。作为首个闯关美国FDA的国产PD-1,今年年初聚光灯下的信迪利单抗遭遇挫折,礼来方面似乎也开始萌生退意。
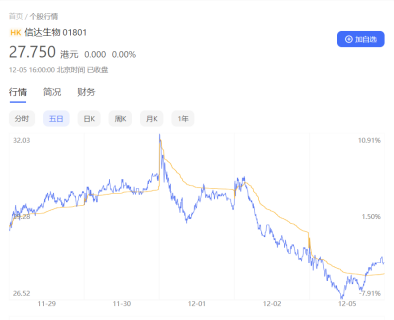
消息一经传出,信达生物港股表现应声下跌。
事实上,信达生物与礼来在2015年达成授权合作协议,宣布共同开发信迪利单抗,这一“里程碑”事件也被业内视为中国Biotech发展的标志性事件之一。出海受挫是否是造成双方“分手”的主要原因?《医药经济报》新媒体中心就相关情况向信达生物进行了求证。
信达生物方面对信迪利单抗本次合作变化情况予以确认,并表示双方“分手”其实是信达生物在近期主动积极与礼来方面友好协商的举动,双方出于商业决策和未来发展的衡量,决定由信达生物收回信迪利单抗的海外权益。
双方为“友好协商”
“2亿美元首付款无需退回”
礼来和信达生物关于信迪利单抗的合作始于2015年。当年3月和10月,礼来和信达生物两次签订战略合作协议,针对3个单抗(包括信迪利单抗)和3个双特异性抗体项目的开发达成战略合作。
2020年8月,双方扩大信迪利单抗全球战略合作,礼来获得该药物在中国以外区域的独家许可,并计划将其推向美国和其他地区市场。信达生物获得2亿美元的首付款和8.25亿美元的开发和销售里程碑付款,另外还将收到两位数比例的净销售额提成。
看似皆大欢喜的合作局面,在2022年急转直下。2022年3月,信达生物在港交所发布公告称,美国FDA未批准信迪利单抗联合培美曲塞和铂类化疗用于非鳞状非小细胞肺癌患者一线治疗的新药上市申请。在此前的监管会议上,FDA曾经表示,信达/礼来在试验结束前没有咨询监管机构的意见就提交了申请,并且在申请的过程中没有与监管机构(FDA)进行持续沟通。
随即,信达生物方面表示将与礼来评估信迪利单抗于美国的下一步行动。显然,本次海外申报上市遇阻,让信迪利单抗的海外市场布局产生了更多的不确定性。
对于本次收回信迪利单抗的海外市场权益,显然透露出一些信号。信达生物表示,收回信迪利单抗的海外权益将对公司肿瘤管线的综合布局有益,PD-1作为最重要的肿瘤免疫治疗药物,除已获批的适应症外,更有与其他肿瘤管线联用的多方面潜力,LAG3、TIGIT等多个靶点都在探索与PD-1联用的适应症,未来肿瘤管线的综合布局将有更多主动性和灵活性。
事实上,围绕信迪利单抗的销售推广,即使在中国本土市场,信达和礼来已经有所调整。早在2021年底,礼来方面就透露将收缩公司在中国区的PD-1销售团队,并于2022年1月将信迪利单抗销售全部转回给信达生物。
本次“分手”事件,让资本市场不无猜测:礼来与信达关于信迪利单抗产品的合作是否完全终止?双方其他合作是否会有影响?对此,信达生物明确表示,本次决定不会影响信达和礼来在中国市场的合作,也不会影响两家合作伙伴长久以来所建立的战略合作关系,更不会影响在其它产品上的合作;在中国市场,礼来制药继续与信达生物保持高度合作。
除此之外,礼来曾在2020年期间向信达生物支付了2亿美元的预付款,“分手”事件之后,双方财务处理也成为了关注的焦点。信达生物回应表示,此次“分手”为双方友好协商,因而信达生物此次收回权益无需向礼来方面支付任何费用;此外,信达此前收到的2亿美元授权首付款项也无需退回。
对于信达如何看待信迪利单抗的出海前景,是自主出海还是另寻新的海外合作伙伴,信达并未给出直接结论。
信达生物表示,在收回PD-1的海外权益后,公司会积极思考PD-1的海外策略。主要考虑几个原则:第一,PD-1作为肿瘤免疫治疗的基石,具有重要的临床价值;第二,任何一个市场的开拓与否,都应考虑投入和产出能否带给公司正向的回报;第三,任何公司研发的资源和资金都是有限的,从投入回报的角度,研发资源的布局应该投入在更具有潜力、有更高潜在回报的创新分子管线上。
本土创新正当时
Biotech与MNC合作加速
不难看出,虽然本次信达生物从礼来方面收回了PD1的海外权益,但是其他关于信迪利单抗产品与礼来方面的合作,比如联合治疗、新适应症的探索研发管线仍在继续推进中。
另外,截至目前,信达与礼来的合作还有很多:
2019年8月,信达生物和礼来达成合作,在中国共同开发和商业化GLP1/GCGR双重激动剂IBI362,礼来开发的一款在研胰高血糖素样肽-1受体(GLP-1R)和胰高血糖素受体(GCGR)双重激动剂,适用于2型糖尿病和减重。截至信达2022年半年报数据披露,产品正处于2期临床向2期/3期关键性临床阶段推进中。
2020年10月,由礼来制药和信达生物制药共同研发的利妥昔单抗注射液(商品名:达伯华)获批上市,用于治疗弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤及慢性淋巴细胞性白血病。这是国内获批上市的第二款利妥昔单抗生物类似药。
2022年3月,由礼来研发的雷莫西尤单抗(商品名:希冉择)在中国地区获批,信达生物方面也从礼来获得了产品在中国的独家商业化权利,全权负责希冉择(雷莫西尤单抗)的定价、 进口、 营销、分销和销售推广。同时,礼来授予信达生物在中国大陆进口、销售、推广和分销全球首个且唯一的不限癌种用于治疗RET基因融合实体瘤的RET抑制剂塞普替尼(Selpercatinib)获批后独家商业化权利。
虽然,双方合作仍在继续不断地加深,但不难看出随着双方信迪利单抗产品与其他国产PD-1产品闯关FDA接连受挫后,市场整体对国产PD-1重启前景并非十分乐观。
无独有偶,EQRX在此前也宣布将不再寻求没FDA批准基石药业PD-L1舒格利单抗(Sugemalimab )加化疗治疗第四期NSCLC;诺华在公布2022年2季度财报时,披露了他们对于新的药政申请递交的计划,诺华决定暂不继续推进原定于今年下半年在美国递交替雷利珠单抗用于二线治疗非小细胞肺癌(NSCLC)的上市许可申请的计划。
有业内观点指出,这或许是因为国产PD-1产品严重扎堆所造成的问题,产品同质化现象严重,对美国市场而言,如果细分领域的适应症临床需求度基本得到满足,市场竞争力不高,这将难以切入美国市场。
不过,随着国内Biotech/Biopharma创新实力不断增强,MNC的产业链合作也在不断深化。
据不完全统计,百济神州已与诺华、默克、安进、BMS、BioAtla 以及 Zymeworks 等国内外国家企业达成合作,涉及PD-1、BTK、CD3、CD19、HER2 等多个靶点产品。其中包括与诺华、Nanolek、默克等企业达成海外授权;赛诺菲也在2022年8月,溢价20%入股信达生物在医药界掀起了一场波澜。有资本行业人士观点认为,虽然现在中国医药环境是低谷,biotech的股价跌到低谷,但此次MNC的品牌背书,就像“寒冬里的一针强心剂”。
随着近年创新药浪潮席卷到传统药企,License-out也正在成为转型中的传统药企国际化的敲门砖。科伦14亿美元合作默沙东、石药12亿美元合作Elevation Oncology,济民可信6亿美元合作基因泰克等,越来越多的数亿美元甚至十几亿美元的License-out诞生自传统药企。
对于本土生物医药企业而言,“In China For Global”的战略固然重要,但如何培养好研发人才,立足创新根本,瞄准未被满足的临床需求,形成差异化竞争力,从长期发展角度出发才是立足全球市场的根本。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx