金斯瑞生物科技日前发布公告,传奇生物的细胞疗法CARVYKTI(西达基奥仑赛)今年在三季度实现净销售额5500万美元,环比二季度2400万实现翻倍式增长,两个季度合计销售额约合5.7亿人民币,超出市场预期。西达基奥仑赛再次体现强大市场潜力。

西达基奥仑赛于今年2月28日获美国食品药品监督管理局(FDA)批准上市,成为首个国内自主研发在海外获批上市的细胞疗法,用于治疗既往接受过4种或更多种疗法的复发或难治性多发性骨髓瘤成人患者。此后,于5月26日获得欧盟委员会(EC)附条件上市许可,9月27日获得日本厚生劳动省上市批准,在国内也即将申报上市。
传奇生物西达基奥仑赛在美国的成功获批和商业化,开启了国产创新生物药出海欧美的先河,也凸显了差异化创新产品的临床价值和市场价值。
“当前,国内细胞治疗渐渐呈现内卷困局!”业内专家指出,国内CAR-T疗法研发靶点过于集中,商业化周期长;同时,CAR-T疗法虽在治疗血液恶性肿瘤上取得了可喜进展,但在治疗实体瘤方面仍面临诸多挑战。
内卷如斯,差异化创新、海外上市成为CAR-T赛道上药企的新出路。传奇生物西达基奥仑赛在海外上市畅销,不仅为国内药企提供了产品出海思路,更鼓励着国内药企在CAR-T领域参与全球化竞争。
全球商业化有出路
创新产品如何“出海”?
作为一种新兴的疗法,CAR-T疗法在过去几年里发展火热,集中上市,成为资本关注的焦点。
2017年9月 靶向CD19
全球首个CAR-T疗法Kymirah获批,用于治疗25岁以下复发性或难治性B-细胞急性淋巴细胞白血病患者。
2017年10月 靶向CD19
FDA批准吉利德的Yescarta用于既往接受二线或多线系统治疗的复发性或难治性大B细胞淋巴瘤(LBCL)成人患者的治疗。
2021年3月 靶向BCMA
由BMS与蓝鸟生物联合研发的Abecma于被FDA批准用于治疗复发性/难治性多发性骨髓瘤(R/R MM)成人患者。
2021年6月 靶向CD19
中国首款细胞治疗产品,复星凯特的CAR-T产品阿基仑赛获国家药监局上市批准,用于治疗成人复发难治性大B细胞淋巴瘤。
2021年9月 靶向CD19
药明巨诺的倍诺达被NMPA批准用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)。
目前已经获批上市CAR-T疗法,以CD19靶点居多。回溯细胞疗法在血液瘤治疗领域的发展历程,虽然西达基奥仑赛并非全球首款获批上市的BCMA CAR-T疗法,但从临床获益方面来看,西达基奥仑赛同样值得期待。
在关键性CARTITUDE-1研究中,西达基奥仑赛治疗末线主要终点总缓解率ORR/完全缓解率(s)CR达98%/78%,而Abecma为72%/39%,西达基奥仑赛有明显的优势。此外,中位(数)无进展生存期mPFS超过2年,高于同类疗法平均8-12个月。
在国际政治经济环境复杂的背景下,传奇生物还能实现自主研发产品在美国FDA获批,归根结底是它的产品为同类最佳,安全性、有效性等数据相比已上市产品有显著优势。
根据传奇生物去年10月研发日公布的临床开发计划,后续还将开展针对更前线治疗的临床试验。
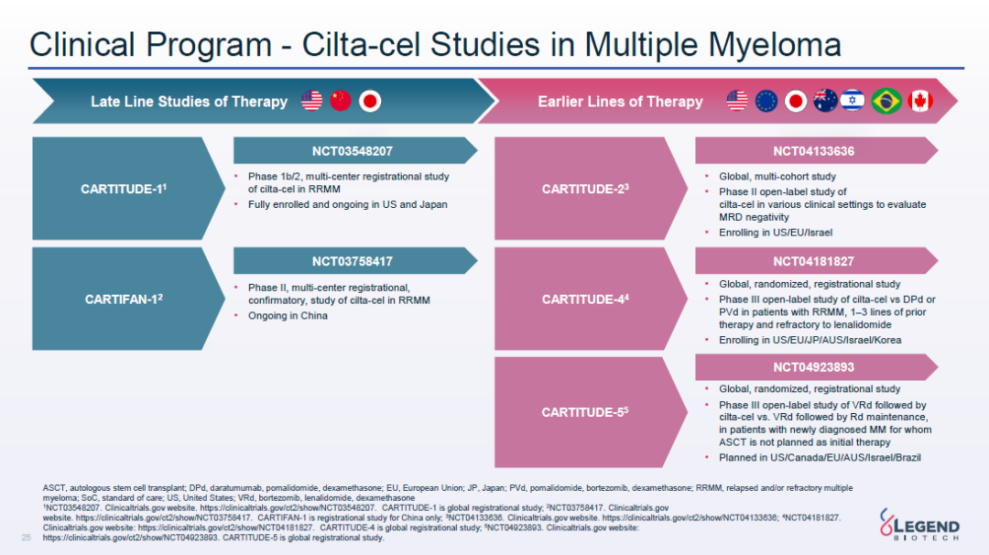 西达基奥仑赛(Cilta-cel)多发性骨髓瘤开发计划
西达基奥仑赛(Cilta-cel)多发性骨髓瘤开发计划
2017年12月,传奇生物与强生签订了独家全球许可和合作协议,以共同开发和商业化西达基奥仑赛。这笔交易仅预付款就高达3.5亿美元,在当时国内license-out授权中排名前列。根据该协议,在全球市场中,传奇生物和强生的成本和利润分摊比例为50/50。此后,两家公司携手推进西达基奥仑赛的开发进度。
按照与强生50%的分成条款,西达基奥仑赛在海外上市后前两个季度传奇生物就实现了接近3亿元的收入。
在美国,诺华的Kymriah、吉利德的Yescarta、传奇生物的Carvykti分别定价47.5万美元/针、37.3万美元/针、46.5万美元/针,前两者分别在2021年实现5.87亿美元、6.95亿美元销售。
反观国内,在2021年上市的复星凯特的奕凯达、药明巨诺的倍诺达价格分别为120万元/针和129万元/针,当年分别实现销售额约1亿元、3079.7万元。2022年上半年药明巨诺的开具了77张倍诺达处方,实现销售收入约6600万元。对比之下,CAR-T产品的海外市场销售额远超中国。
研发端内卷 支付端受限
国内CAR-T商业化步履维艰
作为近几年抗癌疗法的宠儿,CAR-T疗法的有效性陆续得到验证,从临床研发走向商业化。根据沙利文分析,预测在2030年全球CAR-T疗法的市场规模将达到218亿美元。
市场潜力巨大,国内多家细胞治疗公司也纷纷跟风研发,积极布局CAR-T市场。目前,国内已批准复星凯特、药明巨诺2款靶向于CD19的CAR-T疗法。

此外,据行业信息统计显示,还有十余款靶向CD19的CAR-T细胞治疗产品临床试验项目正在开展。
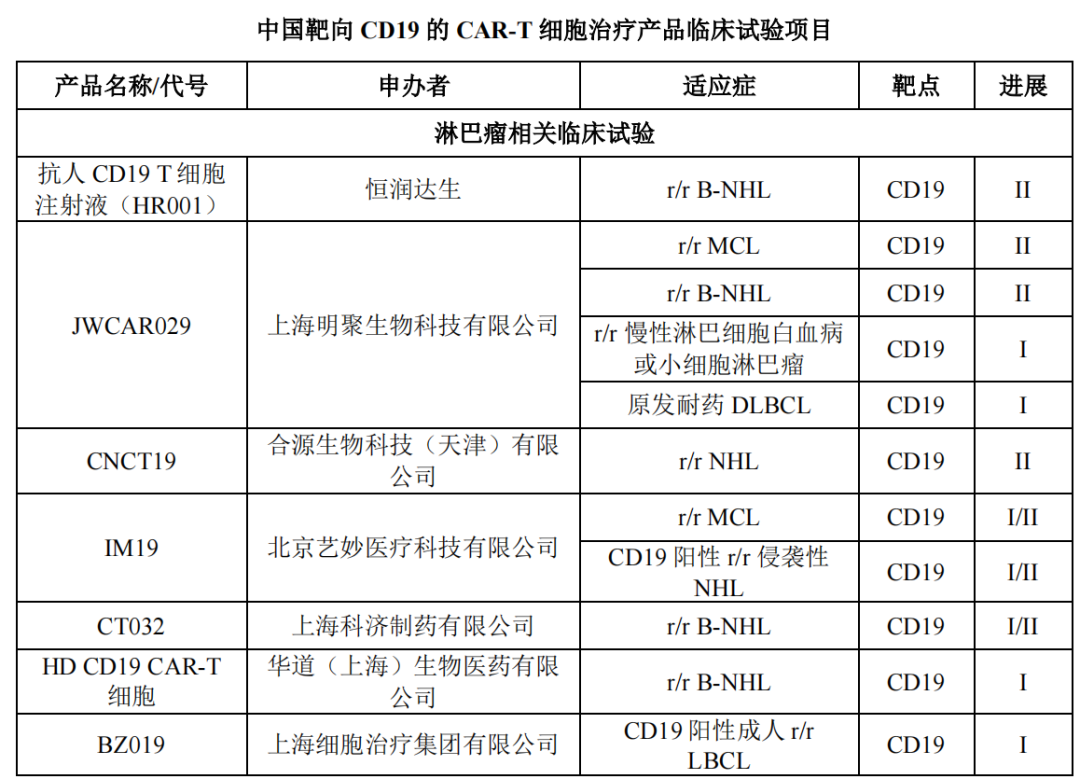
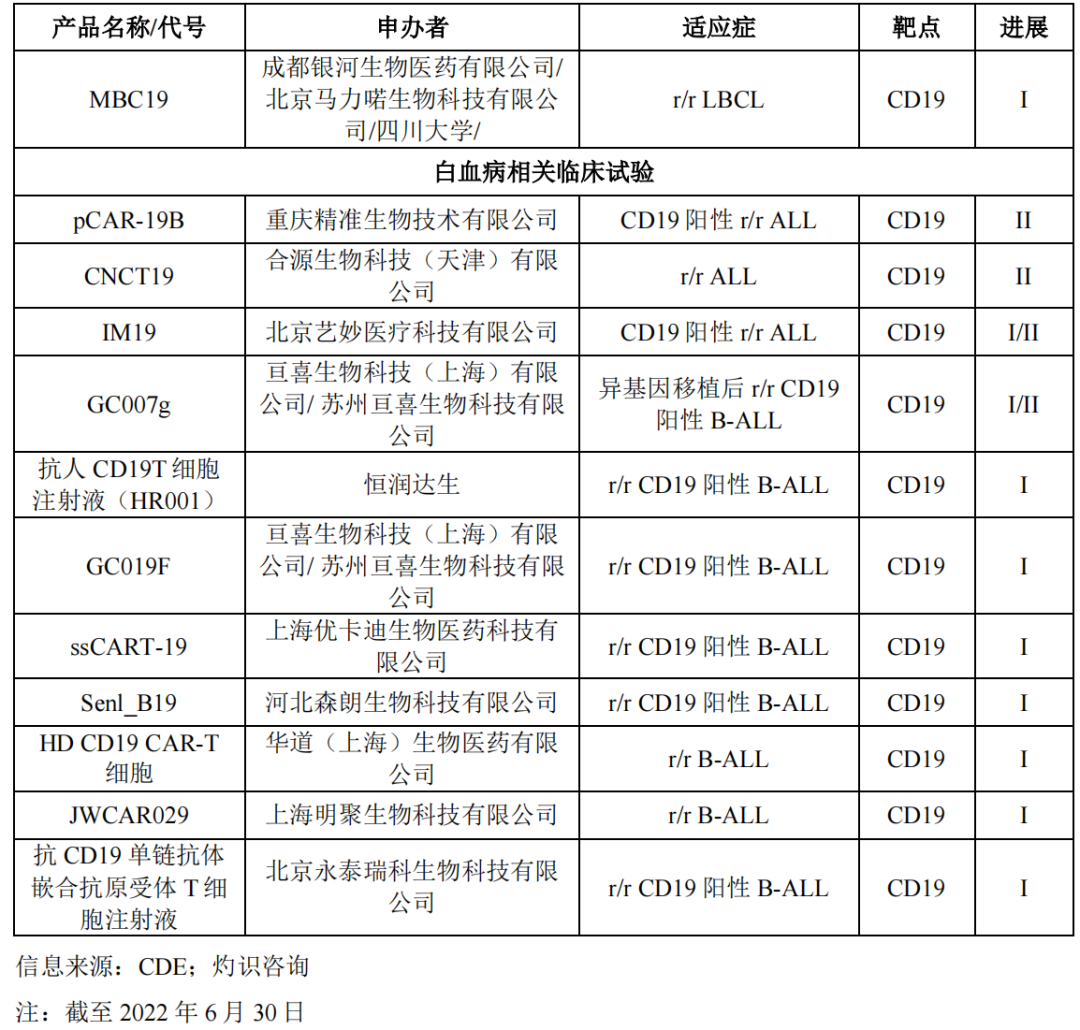
除了热门的CD19靶点以外,靶向BCMA的CAR-T细胞治疗产品竞争也不容小觑。
10月18日,科济药业宣布,其全人抗自体CAR-T产品泽沃基奥仑赛的新药上市申请(NDA)已获CDE受理,用于既往接受过至少一种免疫调节剂和蛋白酶体抑制剂治疗失败的复发或难治性多发性骨髓瘤(R/R MM)成年患者。这也是继今年6月信达生物/驯鹿医疗的伊基仑赛注射液之后第2款在国内申报上市的BCMA CAR-T产品。
目前,全球范围内已有2个靶向BCMA的CAR-T细胞治疗产品上市。在国内,除了上述2款靶向BCMA的CAR-T细胞治疗产品已提交NDA外,还有4项靶向BCMA的CAR-T临床试验项目在CDE药物临床试验登记与信息公示平台注册登记。
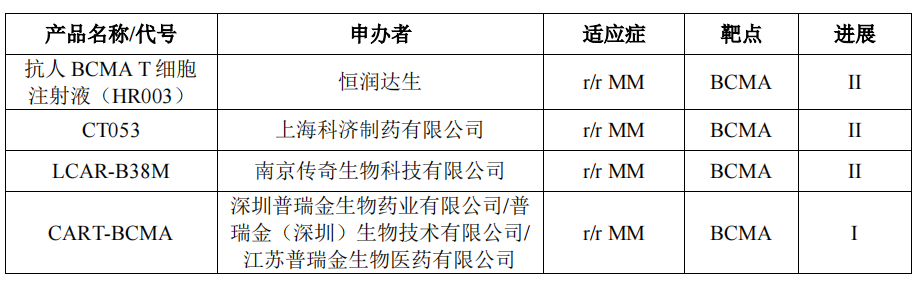
据《医药经济报》新媒体中心统计,国家药监局已收到CAR-T疗法的上市申请超过27项,包括复星凯特、药明巨诺、科济药业、信达生物/驯鹿医疗、亘喜生物、永泰生物、传奇生物等。
为了争抢CAR-T疗法的市场先机,各家药企不惜重金砸向研发,这与PD-1的情况极其相似,今后的市场争夺必将越来越激烈。
与其他创新药不同,CAR-T产品的成本其实并不取决于企业自身。目前,国内已上市CAR-T产品较贵,主要源于其需要个性化制备、较贵的进口载体等材料以及产品制备量太少无法形成规模效应。即使目前药明巨诺的瑞基奥仑赛注射液采购挂网价129万/针,复星凯特的阿基仑赛注射液120万/针,但对企业而言,利润空间依然很薄。
药明巨诺2021年度亏损达7亿元,瑞基奥仑赛销售额3079.7万人民币,销售成本高达2175.2万元,毛利为人民币904.5万元,毛利率仅为29.4%,算上研发、管理等费用,瞬间击穿成本线。
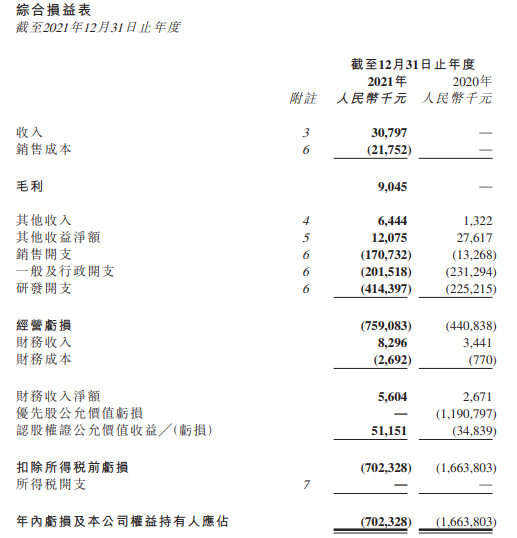
虽然在在2022年半年报中,药明巨诺表示通过施行成本消减计划,上半年毛利率已升至35.0%,但半年也仅开出77张处方。
“药物研发和商业化是两个逻辑。”市场观点认为,很多临床研发的好产品,却最终没有取得很好的商业化结果,CAR-T也面临同样的考验。
如果能够进入医保,显然是解决创新产品市场可及性,提高产品商业终端覆盖的最直接的方法。不过,我国基本医保具有广覆盖、低保障的特征,除非主动降价,否则医保短期内不可能为超百万元一针的药物买单。
事实上,CAR-T产品想要获得医保支持,通过医保谈判获得更广阔的空间,难度不小。今年7月,国家医保局主管的杂志《中国医疗保险》官方微信公众号发表《浅议罕见病用药定价的认知误区》《关于我国罕见病用药保障的几点建议》文章,内容直指“居高不下的销售成本”“避免医保福利化”“药品‘价格虚高’顽疾”等现象。
相比起攻下美国市场的传奇生物,在定价更高的同时,还收获了更多的患者;国内CAR-T产品研发端内卷、支付端受限,商业化步履维艰。
业内人士预测,随着国内创新实力增强、国内市场竞争日益激烈,加之海外创新药市场吸引力大,未来,将会有越来越多的中国创新药选择出海,主动拥抱国际化竞争。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx