因罕见病患者数量太少,而致研发成本高,如单从经济角度来看,罕见病药物(又称“孤儿药”)研发很不划算。但随着我国对罕见病药物系列鼓励政策的出台,以及企业为了避开过于拥挤的赛道,近年来,我国罕见病药物的研发不断提速,本文将从研发阶段、企业排名、孤儿药认定和纳入优先审评审批情况等四个方面,对我国罕见病药物的研发进展做一分析。
PART研究阶段
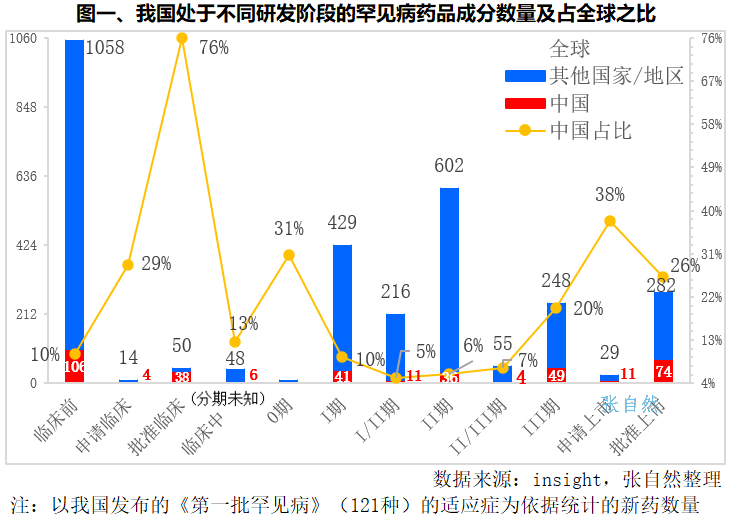
2018年5月22日,由国家卫健委、科技部等五部委联合发布的《第一批罕见病》,共涉及121种疾罕见病。如按这121种罕见病适应症来统计新药数量的话,全球共有2595个药品成分在研,1058个尚处于临床前,国内在研药品成分为331个,显著少于全球仅占全球的12.8%。
我国已批准上市了74种罕见病用药,占了全球282个上市罕见病药物的26%,我国处于临床III期和I期间的分别有49个和41个,临床I期、II期、III期的在研罕见病药物分别有41个、36个和49个,分别占全球的10%、6%和20%。,我国占全球比重最大的是批准临床的罕见病药物研发,共有38个,占了全球50个的76%,其次是申请上市的有11个,占了全球的38%。(详见图一)
企业排名
1、按药物排
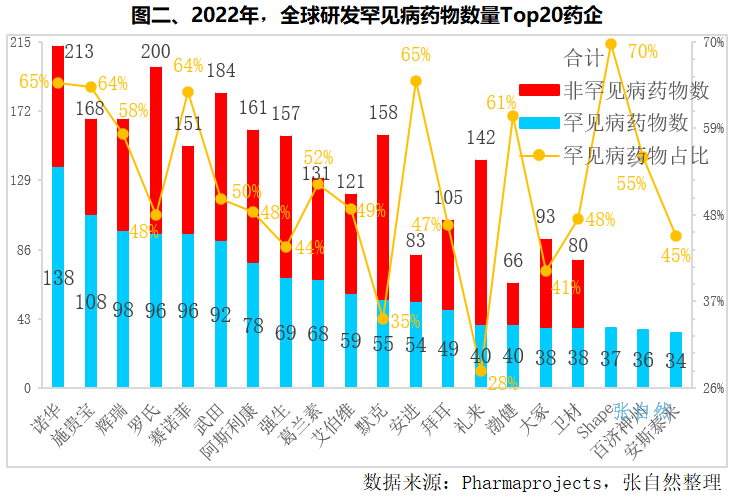
全球研发罕见病药物数量最多的企业是瑞士诺华,共有138个罕见病药物在研,占了其新药研发总数213个的65%,其次是施贵宝和辉瑞,研发的罕见病药物分别有108个和98个,分别占其研发药物总数的64%和58%,罗氏和赛诺菲都各有96个,分别占各自研发药物总数的48%和64%。在研罕见病药物数量占其研发新药总数的比重最大的是ShapeTherapeutics,共有37个罕见病药物在研,占了其研发新药总数的70%。占比在60%以上的依次是安进(占65%)、诺华(占65%)、施贵宝(64占%)、赛诺菲(64占%)和渤健(占61%)。
在Top20企业中,占比最小的是礼来,其研发罕见病药物的数量仅占研发新药总数的不到三分之一(28%),而且是针对一种罕见病开发的,与诺华65%的巨大高占比形成了鲜明对比,其次是默克和日本大冢,分别只占35%和41%。
我国也有一家企业跻身Top20,即百济神州,共有36个罕见病药物在研,排第19位,占其新药研发总数的比例为55%。(详见图二)
尽管经济回报不是最划算,但全球头部药企罕见病药物研发的占比都比较高。
2、按成分排
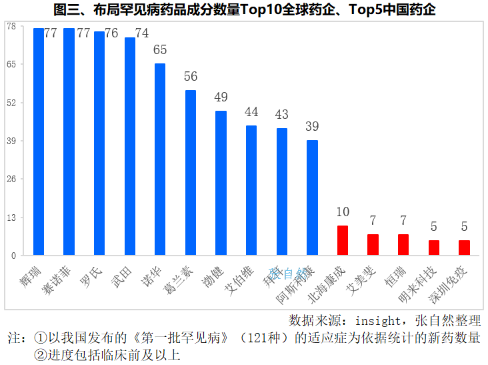
如按涉及的药品成分来划分的话,全球研发立项70个以上罕见病药品成分的企业共有4家,即辉瑞、赛诺菲、罗氏和武田,分别涉及77个、77个、76个和74个罕见病药品成分。其次是诺华(65个)、葛兰素(56个)、渤健(49个)、艾伯维(44个)、拜耳(43个)和阿斯利康(39个)。
我国新药研发涉及罕见病药品成分数最多的是北海康成,有10个,恒瑞和艾美斐生物都有7个,武汉明来科技和深圳市免疫基因治疗研究院各有5个。(详见图三)
资格认定
1、全国
获得孤儿药认定资格,是提高美国FDA审评审批速度的重要渠道。
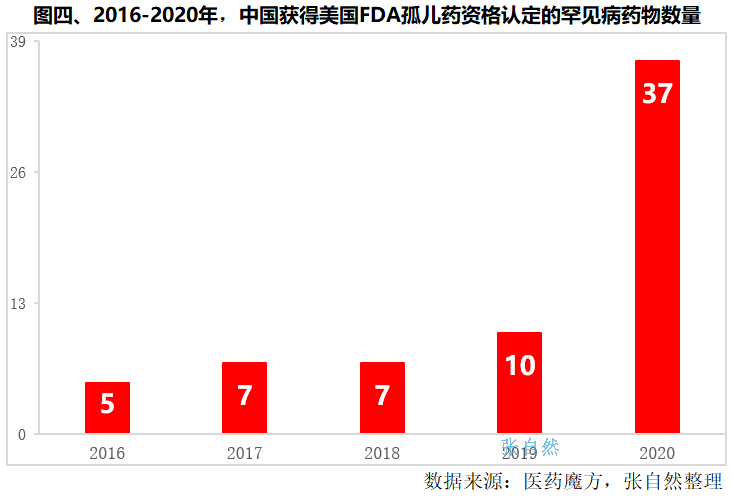
2014-2020年,我国药企共拿下了66个FDA孤儿药资格认定,其中,2020年一年就拿下了37个,比以往历年的总和还多。
近年来,随着医保谈判、带量采购等医保控费政策的压力不断增加,创新药企承受的压力也越来越大,纷纷拟通过加速出海来化解,向美国FDA争取孤儿药资格认定等也成为热门。(详见图四)
2、Top20企业
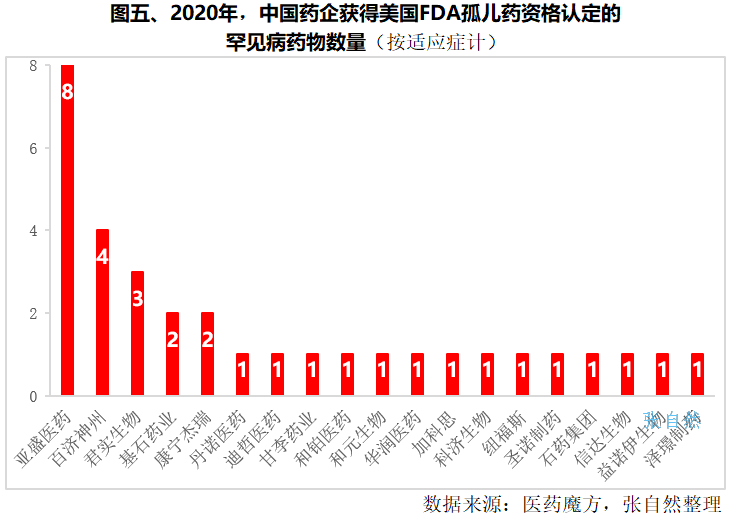
2020年,我国有20多家企业的在研药物获得了美国FDA孤儿药认定资格,其中,杨大俊博士领衔的亚盛医药凭借4款药物囊获8项孤儿药资格认定成为最大赢家,百济神州、君实生物则分别以4项和3项认定位居其后。基石药业和康宁杰瑞各获得了2个认定。(详见图五)
PART
优先审评审批
2017年12月,原国家食药监总局发布的《关于解决药品注册申请积压实行优先审评审批的意见》,明确对治疗罕见病的药品注册申请予以优先审评审批。
2018年5月,国家药监局和卫建委发布的《关于优化药品注册审评审批有关事宜的公告》指出,对于境外已上市的罕见病药品,申请人经研究认为不存在人种差异的,可以提交境外取得的临床试验数据直接申报上市。
2020年7月,国家市场监督管理局发布新修订的《药品注册管理办法》中规定,罕见病的创新药品上市许可申请时,可以申请适用优先审评审批程序并给予审评时限的政策支持。
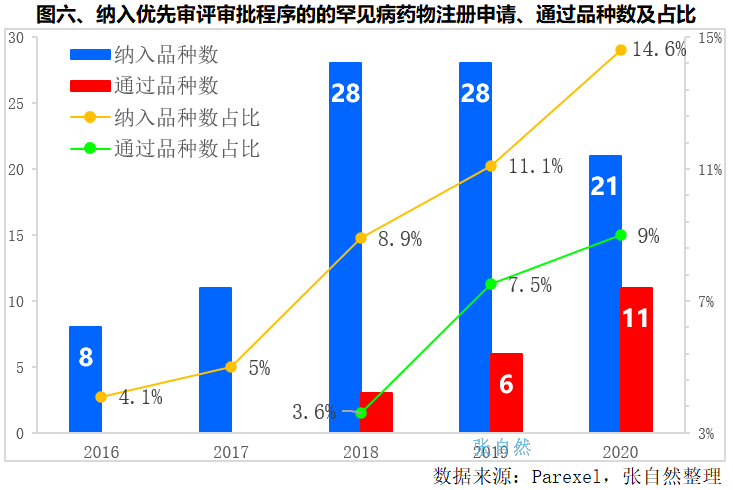
很多罕见病药物通过纳入优先审评审批程序,大幅加快了审评审批速度。纳入优先审评审批程序的罕见病药物由2016年的8个提高到了2018年和2019年的28个,增加了2.5倍,2020年略有下降,为21个,但占纳入优先审评审批药品总数的比重连年上升,由2016年的4.1%提升到了2021年的14.6%,5年提升了10个百分点。(详见图六)
除审评审批提速外,一年一度的国家医保谈判也对罕见病药关爱有加,我国的罕见病药物研发还将提速将保持高速发展。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx