随着2022年年中财报公布,“复星系”成员企业复宏汉霖着实露了脸,在此前并不被看好的生物类似药领域打了一场翻身仗。
8月18日,复宏汉霖公布了2022年度中期业绩,上半年实现营业收入约人民币12.894亿元,较去年同期增长约103.5%;主要来自多款产品陆续商业化带来的销售收入及授权许可收入等,年内亏损2.5亿元(预期今年亏损5亿左右),相比于去年同期的近4亿元亏损大幅收窄。

值得关注的是,核心品种汉曲优
®(曲妥珠单抗),销售收入较去年同期大涨178.2%,引发资本市场高度关注。即使经历了一个周末的冷静期,复宏汉霖股价依旧延续暴涨走势,截至收盘涨幅达到7.57%。
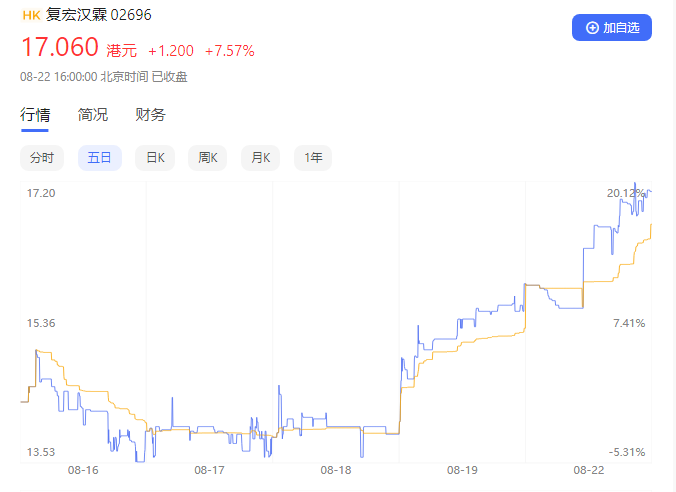
业内观点分析认为,无论是国内药物研发“内卷”,还是生物类似药降价和未来可能的集采,市场对于生物类似药的市场价值普遍存在质疑;然而,复宏汉霖紧紧把握住了市场窗口,单靠一己之力扭转了市场对这一领域的认知:生物类似药依然是一门好生意!
 01
01 Biotech向Biopharma转型“摆脱外部资金依赖”
Biotech向Biopharma转型“摆脱外部资金依赖”复宏汉霖董事长、执行董事兼首席执行官张文杰此前曾公开表示,2022年的复宏汉霖正在从一个Biotech公司向Biopharma公司进化之中。同时,他认为,一家Biopharma的标准之一是“财务上能够靠产品销售支撑业务发展,摆脱对外部资金的依赖。”
细看财报,复宏汉霖显然正在“摆脱外部资金依赖”。不论是在生物类似药领域还是创新药领域,复宏汉霖的表现都可圈可点,汉曲优®(曲妥珠单抗)、汉利康®(利妥昔单抗)、汉斯状
®(斯鲁利单抗)作为复宏汉霖的“三大法宝”;前两者是生物类似药,后者是其首款创新药。
其中,曲妥珠单抗2022年上半年国内销售收入约人民币8.002亿元,较去年同期涨幅约178.2%;截止目前,已在中国、英国、法国、德国、瑞士和澳大利亚等30多个国家获批上市;利妥昔单抗是中国首个生物类似药,今年2月新增类风湿关节炎适应症。2022年上半年公司获得销售收入约人民币2.721亿元。
一款生物类似药“半年收入8个亿”显然是一个令人亮眼的成绩。除此之外,“H药”获批上市,也进一步丰富了企业的商业化产品管线。2022年3月,斯鲁利单抗获国家药监局批准上市,用于治疗经标准治疗失败的、不可切除或转移性微卫星高度不稳定(MSI-H)实体瘤,截至2022年6月底实现销售收入约人民币7690万元。
另一方面,2022年,复宏汉霖销售费用为5.2亿人民币。近三年,复宏汉霖销售费用率由79.12%降至30%左右,企业的销售正逐步向成熟企业靠拢。
市场观点认为,回头再看复宏汉霖这几年的发展,从生物类似药起步,在利剑悬而未落的生物类似药领域,仍能清楚地看到隐藏的利润空间;曲妥珠单抗、利妥昔单抗、贝伐珠单抗、阿达木单抗,四款生物类似药为未来创新研发打下了坚实的基础。
 02
02 “红海”赛道仍有红利?细微差别造就竞争优势
“红海”赛道仍有红利?细微差别造就竞争优势生物类似药一直以来都被认为是一个市场竞争的“红海”,尤其面对未来可能遭遇集采的压力,很多人觉得该领域商业化可能存在市场风险。
以HER2领域为例,曲妥珠单抗原研来自罗氏,是其重磅肿瘤学“三驾马车”之一。2002年罗氏的曲妥珠单抗获批进入中国市场,2017年曲妥珠单抗以65%的降幅进入医保目录,随即快速放量。随着产品专利到期,这也让众多国内企业看到了“专利悬崖”带来的市场机遇。
事实上,作为细分靶点市场竞争最为激烈的领域,HER2药物一直以来都被视为成熟市场,无论是曲妥珠单抗生物类似药,还是Me-too新药,研发赛道竞速者众多,竞争程度早早被行业贴上了“惨烈”标签。
然而,据不完全统计,在研的多款产品中,唯一上市的生物类似药仅有复宏汉霖,而汉曲优
®(HLX-02)却不是研发最早的那一个。
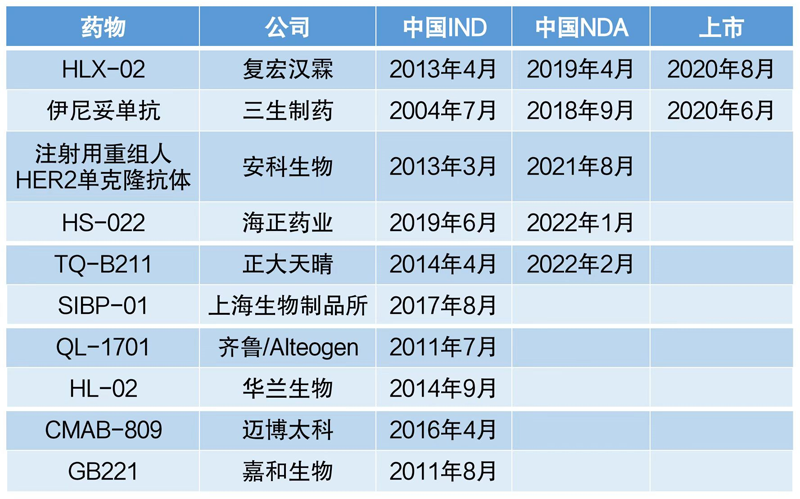
复宏汉霖的曲妥珠单抗生物类似药于2013年申请临床试验,2020年获批上市,总共用了7年时间。在复宏汉霖曲妥珠单抗卖了2年赚近10亿的情况下,早于2011年布局HER2单抗新药的嘉和生物,十年时间过去,目前也一直没有能够提交新药上市申请。
专家在接受采访时表示,无论是小分子药物还是大分子药物,仿制不一定就比研发一款新药更容易。“如果用射击打靶来比喻,新药研发就是‘打哪指哪’,仿制药/类似药研发则是‘指哪打哪’!很多大分子原研产品,批次和批次之间都存在细微的差别,类似药想要做到‘类似’其实是很有挑战性的。”
对此深有体会的,显然是三生制药。赛普汀的临床试验于2004年7月获批,2011年4月该产品曾提交上市申请,不过由于赛普汀随后被纳入《药物临床试验数据自查核查名单》,2016年5月三生制药主动撤回了药品申请。
据中银国际证券发布的研报,分析师认为,如果赛普汀在近期能够补足赛普汀的临床试验数据并在2017年重新申报并获批,则仍将获得国内企业首例上市地位。然而,最终等来的结果却是:三生制药伊尼妥单抗于2018年9月按2类新药提交了上市申请,最终于2020年6月获批。
时至今日,复宏汉霖汉曲优上市到现在,不仅摘下了曲妥珠单抗生物类似药的国内首仿名头,而在两年期间也没有任何一个竞争对手出现,硬生生将生物类似药做出了“市场独占期”。
产品研发开始的早不代表一定会上市,产品上市比别人慢也不代表没有利润。比如恒瑞商业化转化的优势,其卡瑞利珠单抗,虽然是继君实生物的特瑞普利单抗、信达生物的信迪利单抗后,第三个获批的国产PD-1单抗药物,但产品的国内市场销售情况在多家上市产品中都占据着巨大的市场。
业内专家指出,一家企业的竞争优势,研发实力和产品本身仅仅是其中一环,贯穿产品全生命周期的任何一个环节,都可能因为思路、策略、执行、质量等因素的细微差别,最终造成产品在市场端的竞争优势“天差地别”。


