导读:2021年,药审中心共承办新注册申请11569件。其中,化学药品注册申请申报数量为8174件,较2020年增长了2.61%,占2021年全部注册申请申报数量的71%;生物药注册申请申报数量为2006件,较2020年增长了8.49%,占2021年全部注册申请申报数量的17%;中药注册申请申报数量为1371件,较2020年增长了191.08%,占2021年全部注册申请申报数量的12%。
药品注册申请受理情况
>>>>总体情况2021年,药审中心共承办新注册申请11569件(含体外诊断试剂与药械组合,以受理号计,下同),2016-2021年各类药品注册申请数量详见图1。
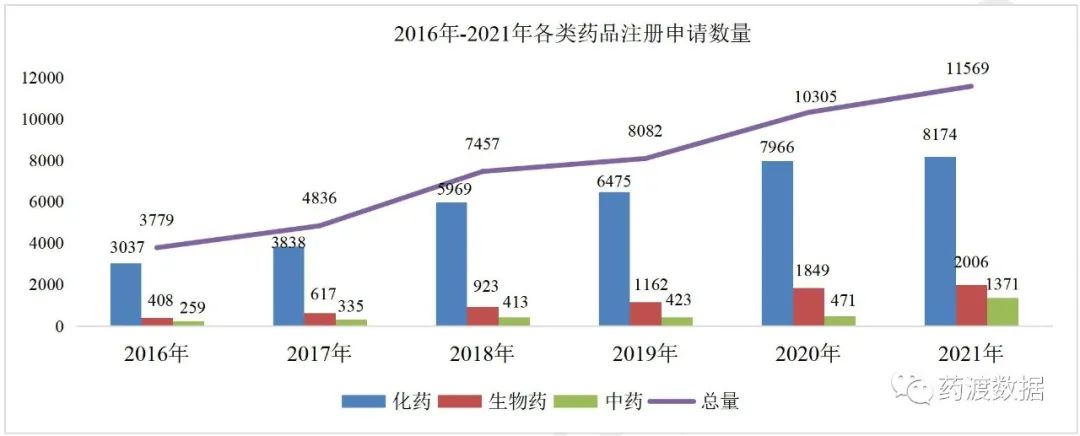
图1 2016-2021年各类药品注册申请数量(单位:件)
注:1.每年药品注册申请中或包含体外诊断试剂,药械组合,药用辅料,药包材和原料药等注册申请,故上图每年注册申请总量或大于中药、化学药、生物药受理注册申请之和。2.文内所有数据为人工整理,或有错误和遗漏,确切数据请前往药渡数据。
其中,化学药品注册申请申报数量为8174件,较2020年增长了2.61%,占2021年全部注册申请申报数量的71%;生物药注册申请申报数量为2006件,较2020年增长了8.49%,占2021年全部注册申请申报数量的17%;中药注册申请申报数量为1371件,较2020年增长了191.08%,占2021年全部注册申请申报数量的12%。国家药品监督管理局通过改革中药注册分类办法和申报资料要求,健全中药技术指导原则等各方面积极鼓励中药创新后,明显改善了中药创新研发动力不足的问题,推动了中药的传承发展。
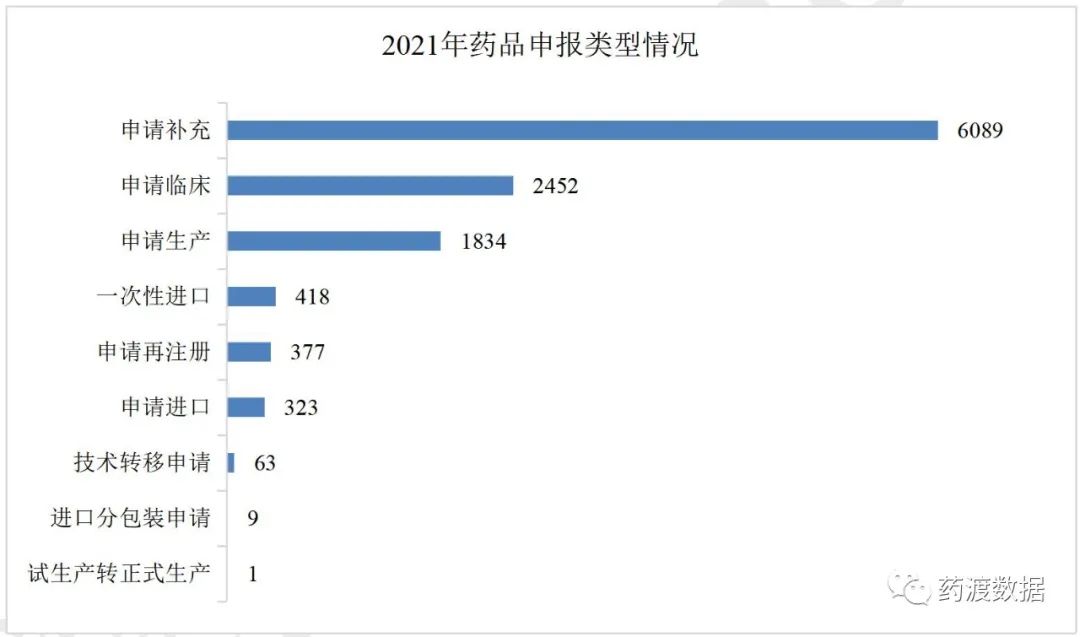
2021年各产品类型申报情况及2021年药品申报类型详见图2、图3。
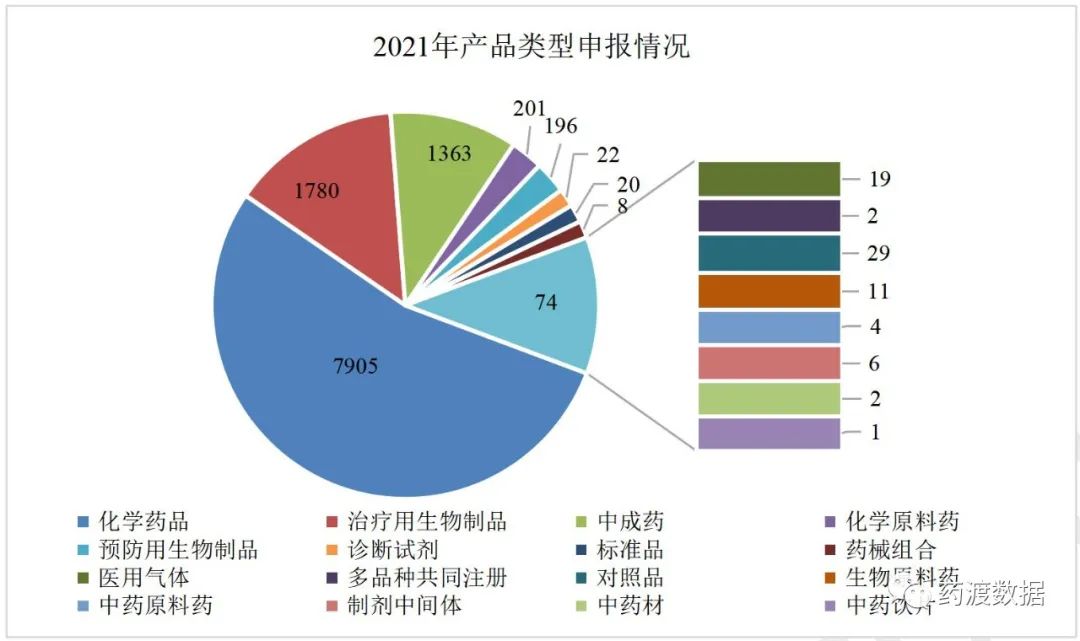
图2 2021年产品类型申报情况(单位:件)
>>>>创新药申报情况
2021年新药注册申请共1933件,其中申请临床1756件,申请上市177件。2016-2021年新药注册申请情况详见图4。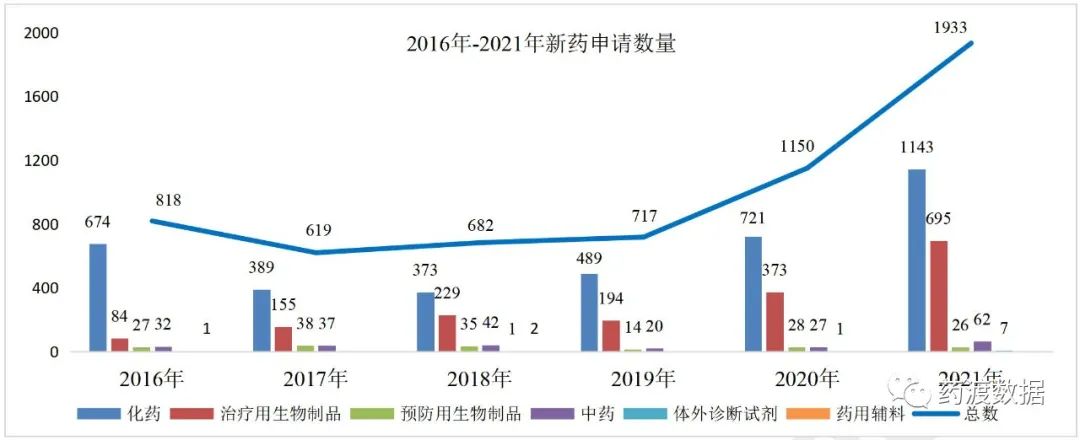 图4 2016年-2021年新药申请数量(单位:件)
图4 2016年-2021年新药申请数量(单位:件)药审中心受理国产1类创新药注册申请1377件,其中申请临床1337件,申请上市40件。按药品类型统计,化学药896件,生物制品481件,创新药的适应症主要集中在抗肿瘤、消化系统和内分泌系统疾病领域。
药审中心受理5.1类化学药进口原研药注册申请169件,受理1类进口创新药注册申请397件,创新药的适应症主要集中在抗肿瘤、消化系统和内分泌系统疾病领域。
药审中心受理化学药注册申请8174件,其中化学药IND申请1488件;化学药NDA 196件;仿制药上市申请(ANDA)1795件。
2021年化学药各类注册申请情况详见图5。
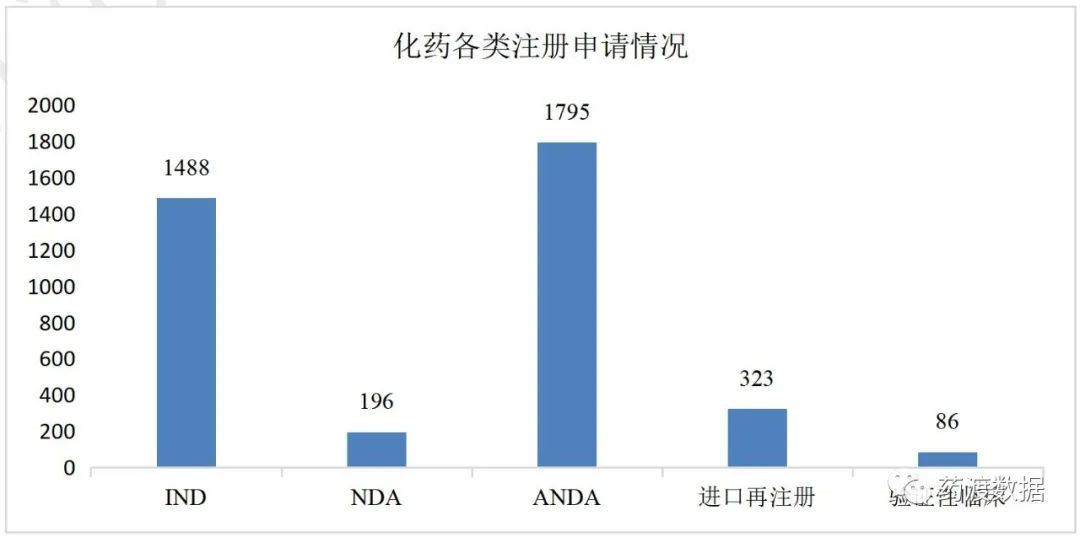
图5 化药各类注册申请数量(单位:件)
药审中心受理中药注册申请1371件,其中中药IND申请52件;中药NDA11件;补充申请367件。
2021年中药各类注册申请情况详见图6。
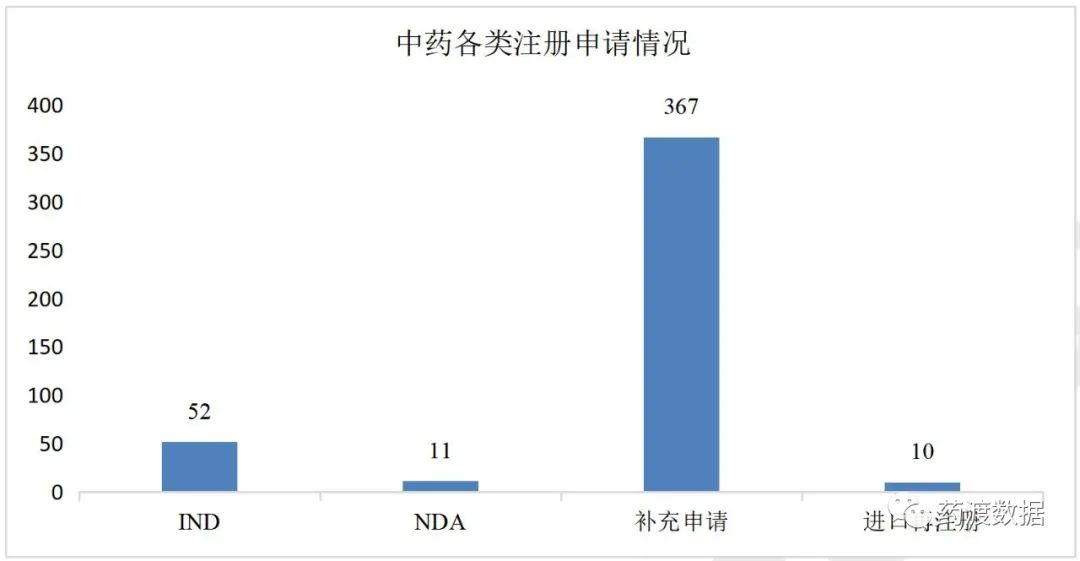 图6 中药各类注册申请数量(单位:件)
图6 中药各类注册申请数量(单位:件)药审中心受理生物制品注册申请2006件,其中生物制品临床申请823件(预防用生物制品临床申请27件,治疗用生物制品临床申请796件);生物制品上市申请162件(预防用生物制品上市申请8件,治疗用生物制品上市申请154件);补充申请901件。临床申请和补充申请占生物制品注册申请全年申报数量的86%。
2021年生物制品各类注册申请情况详见图7。
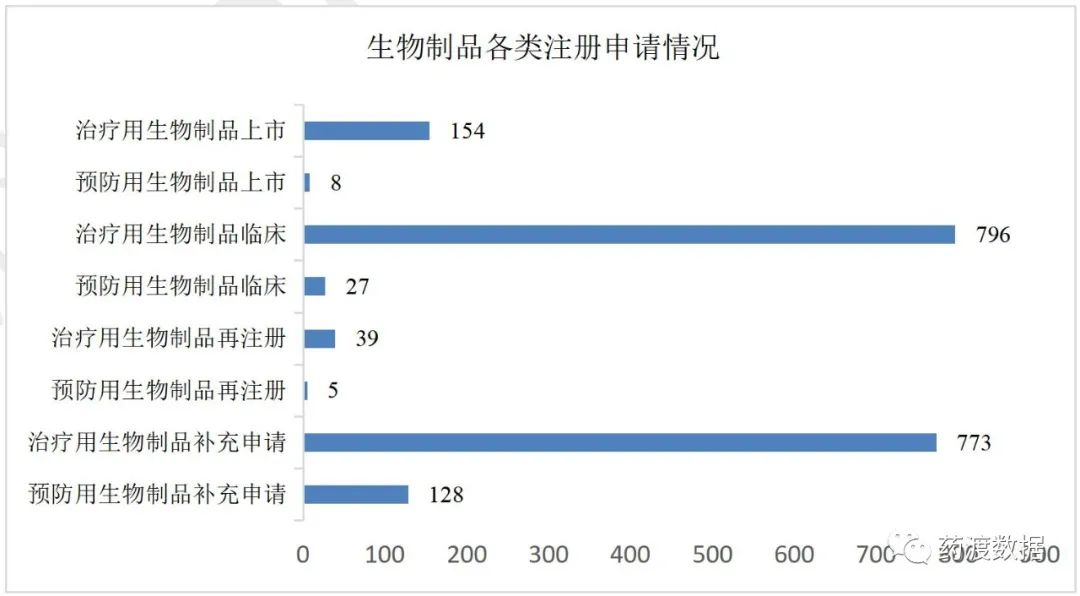 图7 生物制品各类注册申请数量(单位:件)(以上数据来源:药渡—中国批准/注册数据库 )
图7 生物制品各类注册申请数量(单位:件)(以上数据来源:药渡—中国批准/注册数据库 )
药品注册申请审评审批情况
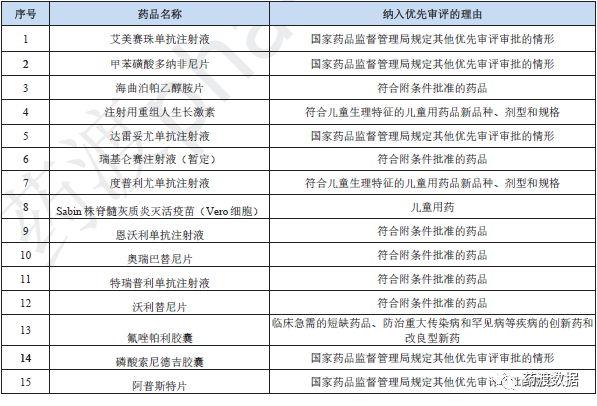
根据国家食品药品监督管理总局《关于鼓励药品创新实行优先审评审批的意见》(食药监药化管〔2017〕126号),《国家药监局关于实施<药品注册管理办法>有关事宜的公告(2020年第46号)》和《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020年第82号)中规定的优先审评审批范围,2021年药审中心公示了106件(64个品种)纳入优先审评程序的注册申请,其中附条件批准的申请占比最大,共42件,占40%。
纳入优先审评程序的注册申请情况详见图8。
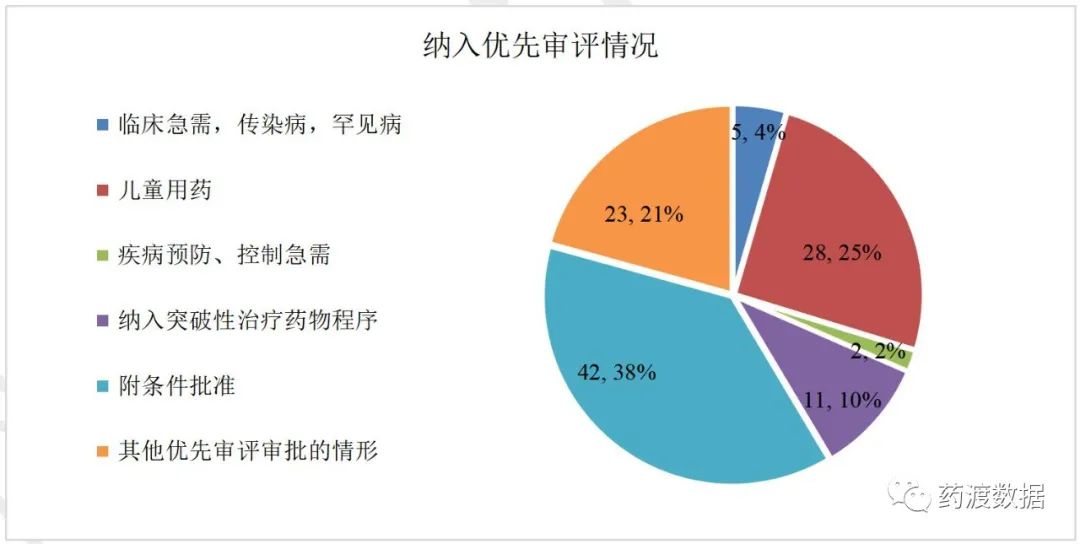 图8 纳入优先审评程序的注册申请情况(单位:件)
图8 纳入优先审评程序的注册申请情况(单位:件)注:个别申请符合多个优先审评适用范围。
表1 2021年纳入优先审评药品名单
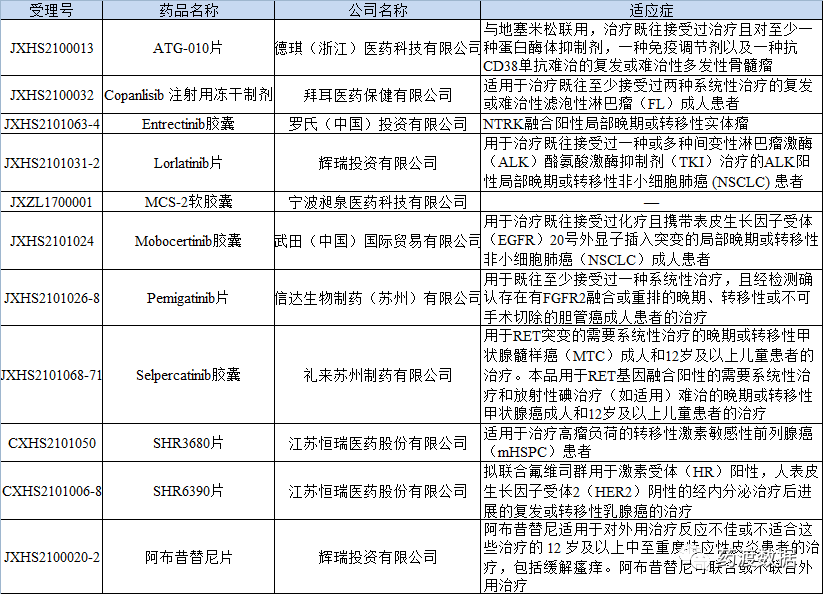
表2 2021年部分完成审评建议批准上市的优先审评药品名单
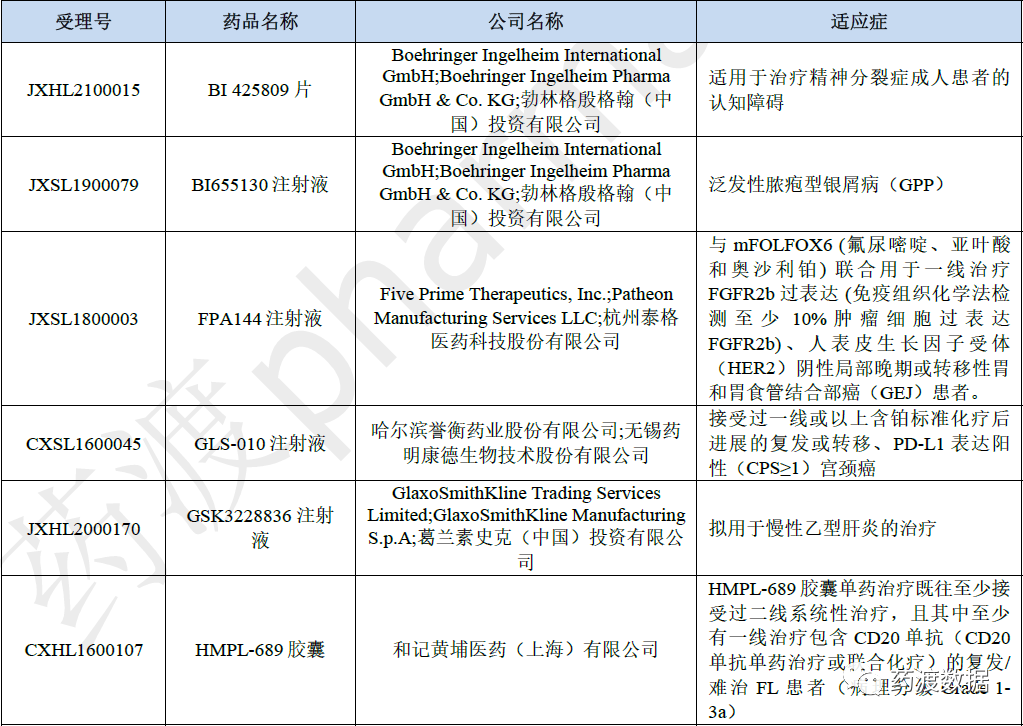
根据《国家药监局关于发布<突破性治疗药物审评工作程序(试行)>等三个文件的公告》(2020年第82号)中的要求,2021年药审中心公示了50件(31个品种)申请并纳入突破性治疗药物程序的注册申请,其中生物药17件,化药23件。
表3 2021年纳入突破性治疗药品名单
2021年在CDE完成审评并获批(只统计NMPA公布的审评结论,不包含其他审评结论来源)的注册申请有7431件。化学药完成审评的注册申请有5352个,其中补充申请3361个,仿制1101个,新药66个,进口185个,进口再注册303,复审2个,一次性进口334个;生物药完成审评的注册申请有858个,其中补充申请591个,新药85个,进口71个,进口再注册48,一次性进口63;完成审评的注册申请有1211个,其中补充申请1186个,新药10个,进口再注册14个,复审1个。
2021年完成审评情况详见图9。
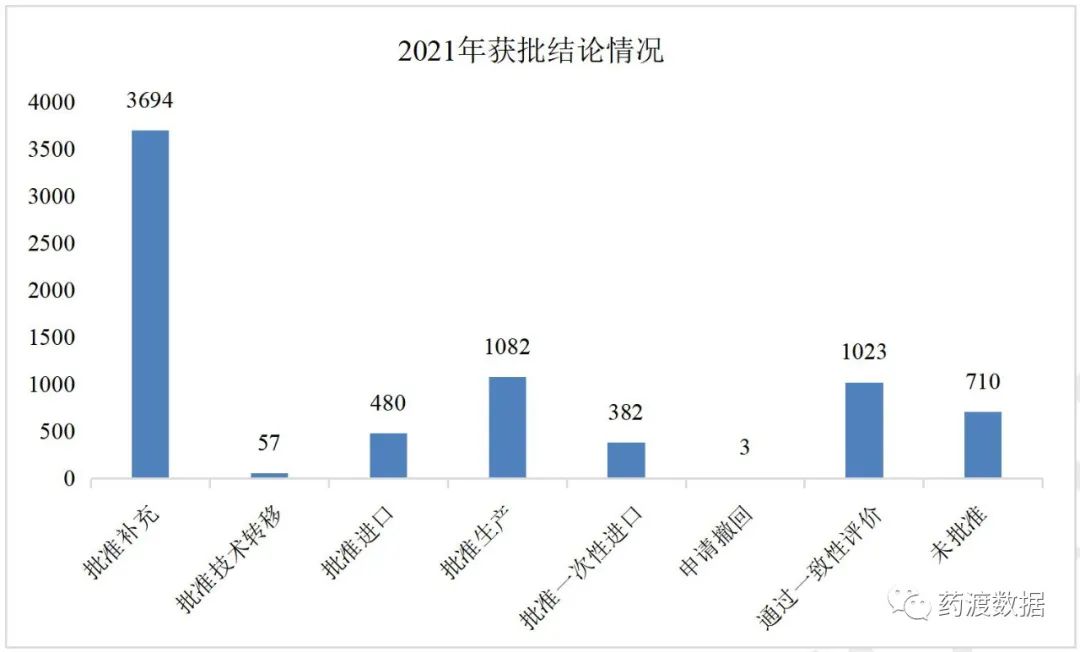 图9 2021年获批结论情况(单位:件)
图9 2021年获批结论情况(单位:件)注:以NMPA官方公布的结论签发日期做统计,统计时间维度不同时统计数量有差异。
2021年批准上市、批准临床和通过一致性评价的药品名单(部分)见下表。表4 2021年部分批准上市药品名单
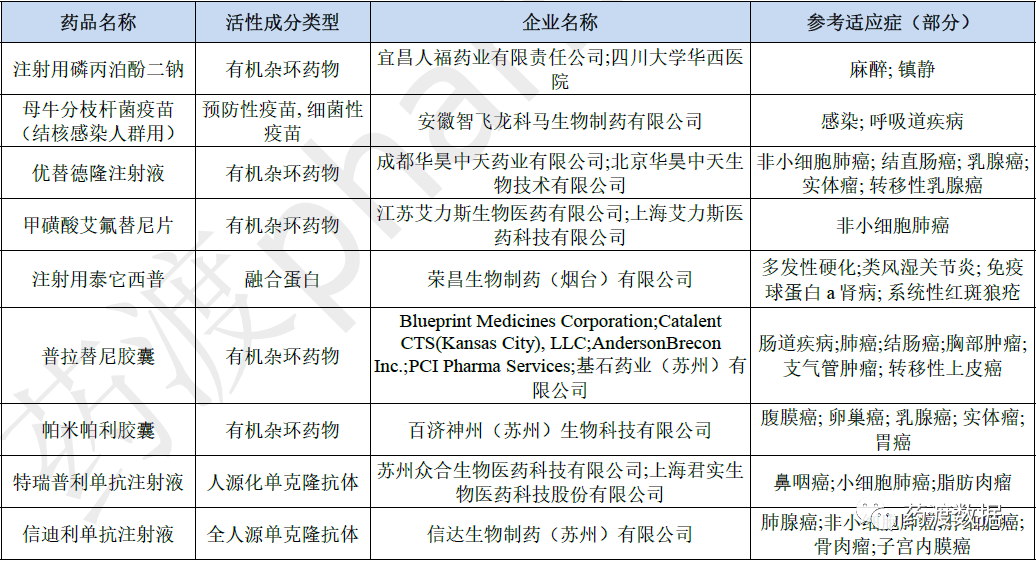
表5 2021年部分批准临床药品名单
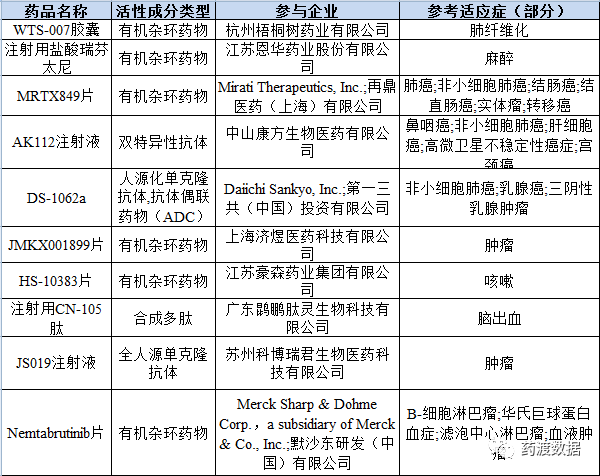
表6 2021年部分通过一致性评价药品名单
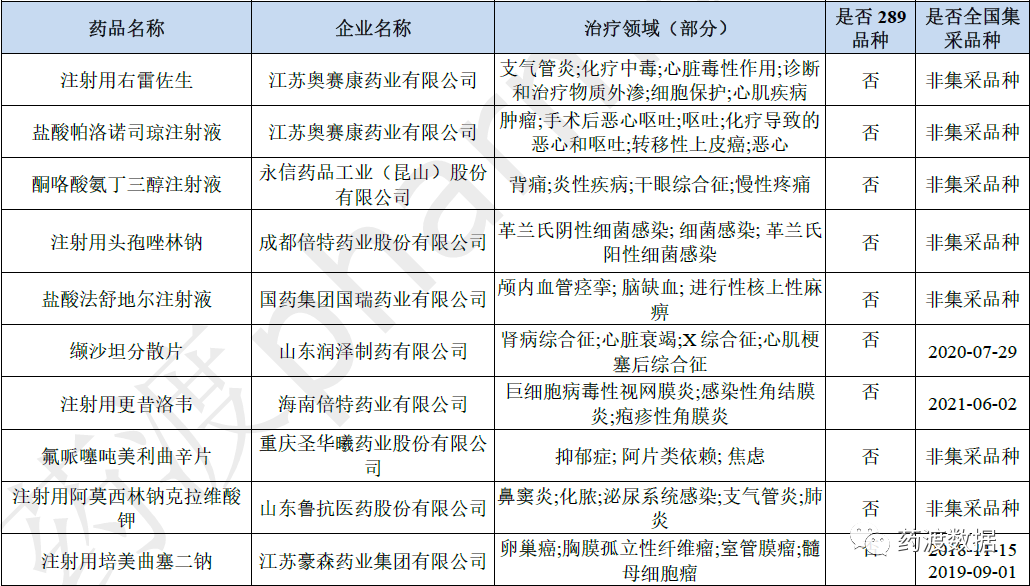 (以上数据来源:药渡—中国批准/注册数据库 )
(以上数据来源:药渡—中国批准/注册数据库 )2021年CAR-T疗法凭借其在治疗血液系统恶性肿瘤方面的显著优势而备受关注,目前全球共有6款CAR-T疗法已获批上市,5款靶向CD19,1款靶向BCMA,中国获批上市2款。
表7 截止至2021年底获批CAR-T情况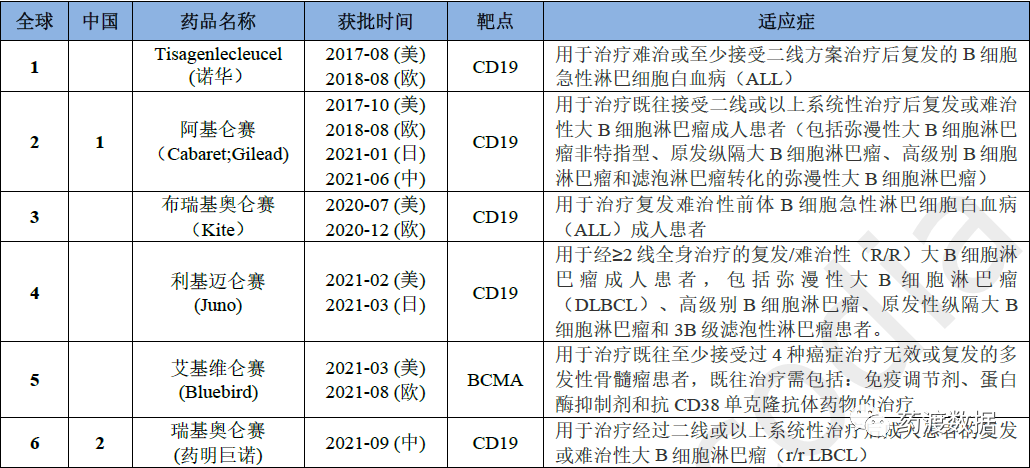
1
阿基仑赛
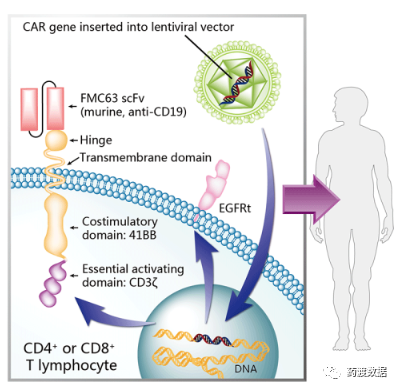
阿基仑赛注射液是由Cabaret Biotech和Gilead Sciences Inc研发的一种自体免疫细胞注射剂,通过携带CD19 CAR基因的逆转录病毒载体进行基因修饰的自体靶向人CD19嵌合抗原受体T细胞(CAR-T)制备。由复星凯特引进美国Kite的CAR-T产品Yescarta®进行技术转移并授权在中国进行本地化生产,是我国首个批准上市的CAR-T药物,用于治疗既往接受二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成人患者(包括弥漫性大B细胞淋巴瘤非特指型、原发纵膈大B细胞淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤)。
上市信息:
2017年10月18日,阿基仑赛获得美国食品药品管理局FDA批准,由Kite Pharma Eu Bv销售,商品名为YESCARTA®。(BLA125643)
2018年08月23日,阿基仑赛获得欧洲药品管理局EMA批准,由Kite Pharma Eu Bv销售,商品名为Yescarta®。(EMEA/H/C/004480)
2021年01月22日,阿基仑赛获得日本医药品与医疗器械局PMDA批准,由第一三共株式会社销售。
(https://www.daiichisankyo.com/files/news/pressrelease/pdf/202101/20210122_E2.pdf)
2021年06月22日,阿基仑赛获得中国国家药品监督管理局NMPA批准(国药准字S20210019),由复星凯特生物科技有限公司销售,商品名为奕凯达®。注射剂规格约为68mL/袋,目标剂量为2.0×10^6个抗CD19 CAR-T细胞/kg体重(可接受范围:1.5×10^6 ~ 2.0×10^6个抗CD19 CAR-T细胞/kg体重),最高为2.0×10^8个抗CD19 CAR-T细胞/剂量。2
瑞基奥仑赛
瑞基奥仑赛注射液是由苏州药明巨诺生物科技有限公司研发的是一种嵌合抗原受体T细胞疗法(CAR-T),同阿基仑赛一样以CD19为靶点,在美国巨诺公司JCAR017的基础上自主研发的中国一类生物制品,用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)。
瑞基奥仑赛注射液的获批基于一项在中国进行的单臂、多中心、关键性研究(NCT04089215),纳入了59 例r/r LBCL且至少经过二线或以上系统性治疗失败后的成人患者,并对这些患者进行长达两年及以上的检测,期望得到长期结果。截止到2020年12月31 日,在58例可评估有效性的患者中,最佳客观缓解率为77.6%,最佳完全缓解率为51.7%,12个月OS为76.8%。在中位随访时间17.9个月中,在59例接受治疗的患者中,≥3级细胞因子释放综合征(CRS)及神经毒性(NT)的发生率分別为5.1%及3.4%。长期随访结果表明瑞基奧仑赛注射液为患者带来了持续缓解和长期生存获益,并有良好的安全性,CAR-T相关毒性发生率低。
上市信息:2021年09月01日,该药获得中国国家药品监督管理局NMPA批准(国药准字S20210035),由上海药明巨诺生物科技有限公司销售,商品名是倍诺达®, 注射剂规格是每支体积约为5mL,含不低于25×10^6 CAR-T细胞。3
Efgartigimod alfa
Efgartigimod alfa(Vyvgart®)是由Argenx研发的一种FCGRT拮抗剂,适用于抗乙酰胆碱受体 (AChR) 抗体阳性的成人全身型重症肌无力 (gMG) 的治疗。Efgartigimod alfa的获批基于一项为期26周的多中心、随机、双盲、安慰剂对照试验(NCT03669588),该试验共纳入167名患者随机接受VYVGART或安慰剂的治疗,使用重症肌无力特定日常生活活动量表(MG-ADL)和定量重症肌无力(QMG)评分测量VYVGART 的疗效,分数越高损伤越严重。主要疗效终点是AChR-Ab阳性人群中治疗组之间第一个治疗周期内MG-ADL应答者百分比的比较,VYVGART 治疗组对MG-ADL的应答率为 67.7%,而安慰剂组为29.7% (p<0.0001);次要终点是第一治疗周期内QMG应答者百分比的比较【VYVGART 治疗组63.1% VS 安慰剂组14.1%(p<0.0001)】,试验结果证明VYVGART治疗达到了积极的治疗效果并且具有良好的安全性。研发里程碑:
2021年10月30日,由Argenx Se开展临床三期试验,用于治疗重症肌无力。(NCT04980495)
2021年09月25日,由Vetter Pharma-Fertigung Gmbh & Co Kg,再鼎医药(上海)有限公司和Argenx BV在中国大陆开展临床一期试验,用于治疗重症肌无力,慢性炎症性脱髓鞘性多发性神经病,血小板减少,天疱疮和自身免疫疾病。(CTR20211952)
2021年09月23日,由Patheon Italia Spa,再鼎医药(上海)有限公司和Argenx BV在中国大陆开展临床一期试验,用于治疗重症肌无力,慢性炎症性脱髓鞘性多发性神经病,血小板减少和天疱疮。(CTR20211952;CTR20211805)
2021年08月25日,由Patheon Italia Spa,再鼎医药(上海)有限公司和Argenx BV在澳大利亚,保加利亚和法国等国家开展临床三期试验,用于治疗天疱疮。(CTR20212085;CTR20212087)
2021年08月25日,由Patheon Italia Spa,再鼎医药(上海)有限公司和Argenx BV在澳大利亚,比利时和保加利亚等国家开展临床二期试验,用于治疗慢性炎症性脱髓鞘性多发性神经病。(CTR20212140;CTR20212141)
2021年08月09日,由Patheon Italia Spa,再鼎医药(上海)有限公司和Argenx BV在中国大陆开展临床三期试验,用于治疗血小板减少。(CTR20211920;CTR20211919)
2021年04月14日,由再鼎医药(上海)有限公司向中国国家药品监督管理局NMPA提交IND申请,用于治疗特发性血小板减少性紫癜。(JXSL2101009)
2021年02月05日,由Argenx Se在西班牙开展临床三期试验,用于治疗重症肌无力。(NCT04818671;NCT04833894;NCT04735432)4
Maralixibat
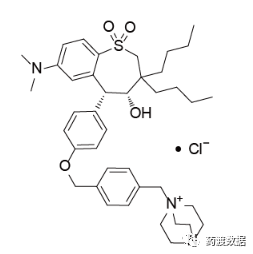
Maralixibat(Livmarli®)是由Mirum Pharmaceuticals Inc研发的一种小分子药物,是一种IBAT抑制剂,适用于1岁及以上Alagille适应证(ALGS)患者胆汁淤积性瘙痒症的治疗。
Maralixibat的获批基于试验NCT02160782,该试验包括18周的开放标签治疗期(5周剂量递增期,13周Livmarli 380mcg/kg每天一次);为期4周的随机、双盲、安慰剂对照的停药期(随机分配继续接受Livmarli或匹配的安慰剂治疗);随后的26周开放标签治疗期(Livmarli 380mcg/kg每天一次);和长期的开放标签延长期。共纳入31名患有胆汁淤积和瘙痒的儿科ALGS患者,随机患者的中位年龄为5岁,所以使用单项观察者通过ItchRO[Obs]报告的结果(瘙痒评分0-4(未观察到-非常严重))来测量瘙痒程度。结果显示给予Livmarli 22周的患者瘙痒症状逐步减轻,而在第18周后退出Livmarli的安慰剂组患者在第22周时恢复到基线瘙痒评分,重新进入开放标签治疗阶段后,到第28周两个随机治疗组的平均瘙痒评分相似,瘙痒症状显著减轻,这些由观察者评价的瘙痒结果得到了5岁及以上能够自我报告瘙痒严重程度的患者评价瘙痒的类似结果的支持。
上市信息:2021年09月29日,该药获得美国食品药品管理局FDA批准,由Mirum Pharmaceuticals Inc销售,商品名是Livmarli®,口服溶液剂规格是9.5MG/EQ 9.5MG BASE/ML。2021年09月14日,由Mirum Pharmaceuticals Inc在阿根廷和奥地利开展临床三期试验,用于治疗进行性家族性肝内胆汁淤积症。(NCT03905330)
2021年09月13日,由Mirum Pharmaceuticals Inc向欧洲药品管理局EMA提交上市申请,用于治疗Alagille适应证。(https://ir.mirumpharma.com/news-releases/news-release-details/mirum-pharmaceuticals-submits-european-marketing-authorization)
2021年09月09日,由Mirum Pharmaceuticals Inc在比利时,法国和波兰等国家开展临床二期试验,用于治疗进行性家族性肝内胆汁淤积症。(NCT04729751)
2021年07月12日,由赛纽仕医药信息咨询(北京)有限公司,Halo Pharmaceutical Canada Inc和Mirum Pharmaceuticals Inc在中国大陆开展临床二期试验,用于治疗胆道闭锁。(CTR20211554)
2021年07月08日,由Mirum Pharmaceuticals Inc在德国,波兰和英国等国家开展临床二期试验,用于治疗胆道闭锁。(NCT04524390)
2021年05月24日,由Halo Pharmaceutical Canada Inc和Mirum Pharmaceuticals Inc在中国大陆开展临床一期试验。(JXHL2100100;JXHL2100099;JXHL2100098;JXHL2100097)
(以上数据来源:药渡—中国批准/注册数据库 ,全球药物数据库)更多研发里程碑与投融资信息详见药渡数据https://data.pharmacodia.com
政策法规
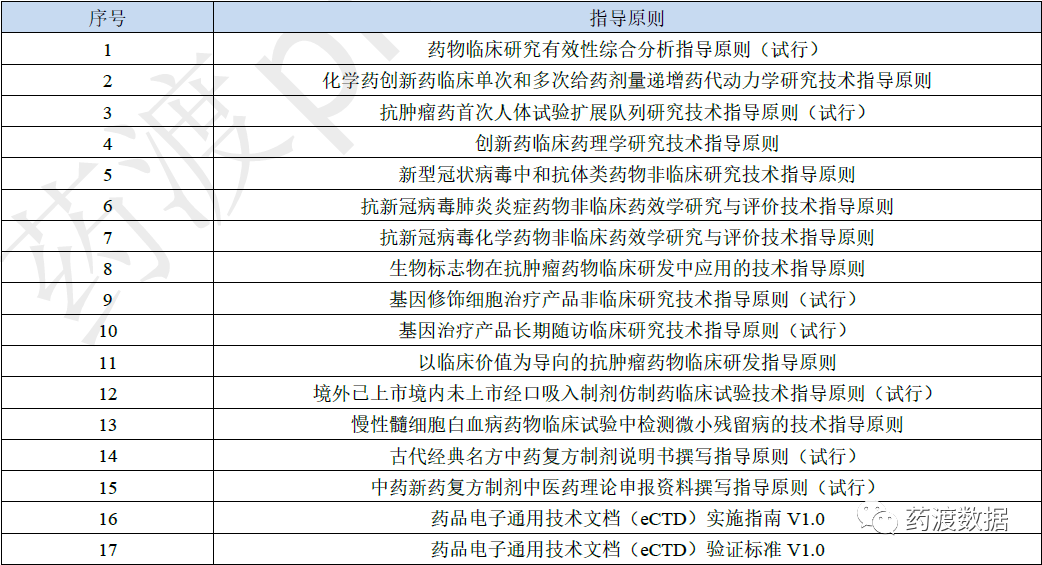
表9 2021年部分政策法规
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx