新药在最终上市前,需要进行两次行政审批:一是临床研究审批,涉及IND(Investigational New Drug)申报;二是临床研究完成注册上市(NDA申报)。
IND的1类新药申请数量从侧面反映出企业研发线上的成熟期创新药项目的储备情况。那么,目前我国申请IND的1类新药申请情况和特点是怎样的呢?
01
申请数量井喷,连续两年过千
2021年,1类新药IND申请的受理号达1765个,较2020年增加了75%;也是连续两年超过1000个。
回顾近几年1类新药IND申请的情况可以发现,从2015年开始,申请数量快速增长,其中,2019年、2020年和2021年连续三年更是一年一个台阶地数量猛窜。
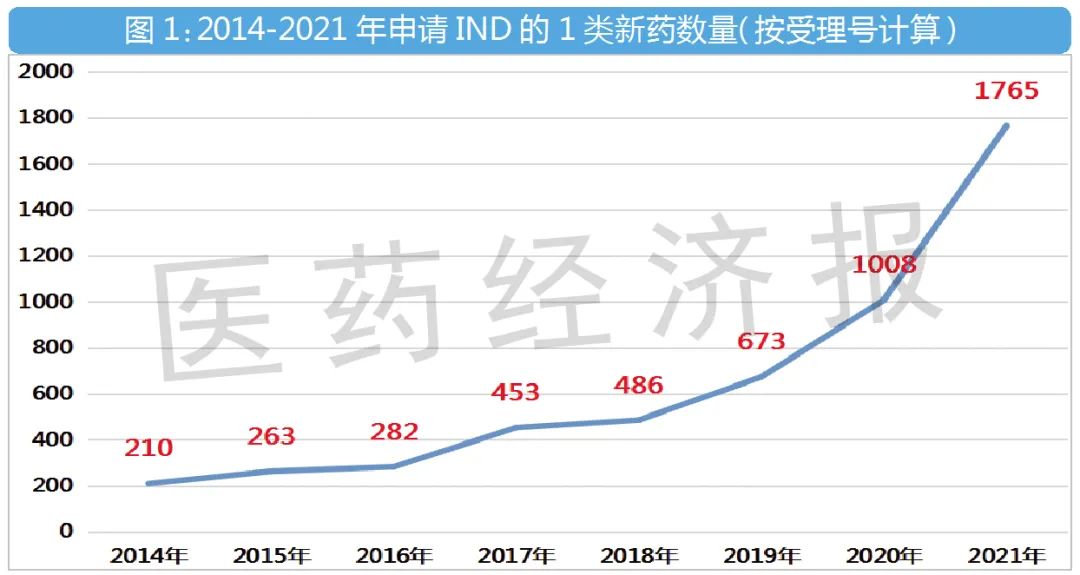
这个数据的背后,是国家不断深化的药品审评审批制度改革。
2015年8月,国务院印发《关于改革药品医疗器械审评审批制度的意见》,提出了优先审评、药品上市许可持有人、项目管理、沟通交流及专家咨询委员会等改革举措以鼓励创新。
2017年10月,中共中央办公厅、国务院办公厅印发《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》,提出了优化临床试验审批程序、接受境外临床试验数据、加快临床急需药品审评审批、支持罕见病治疗药品研发、实行药品与药用原辅料和包装材料关联审批等改革措施。其中包括:受理药品临床试验申请后一定期限内,药品监管部门未给出否定或质疑意见即视为同意,注册申请人可按照提交的方案开展临床试验。
2018年7月27日,国家药监局发布《关于调整药物临床试验审评审批程序的公告》,明确提出60日临床审评时限,临床审评速度从平均16个月缩短至60天。 2020年7月1日,新修订的《药品注册管理办法》正式实施。与近年药品审评审批制度改革的相关改革措施一起,构建了新的药品注册管理体系。
几乎每一个重大改革措施之后,申请临床的1类新药数量就会有一次大幅增长。
02
化学药申报数量最多,占比减少
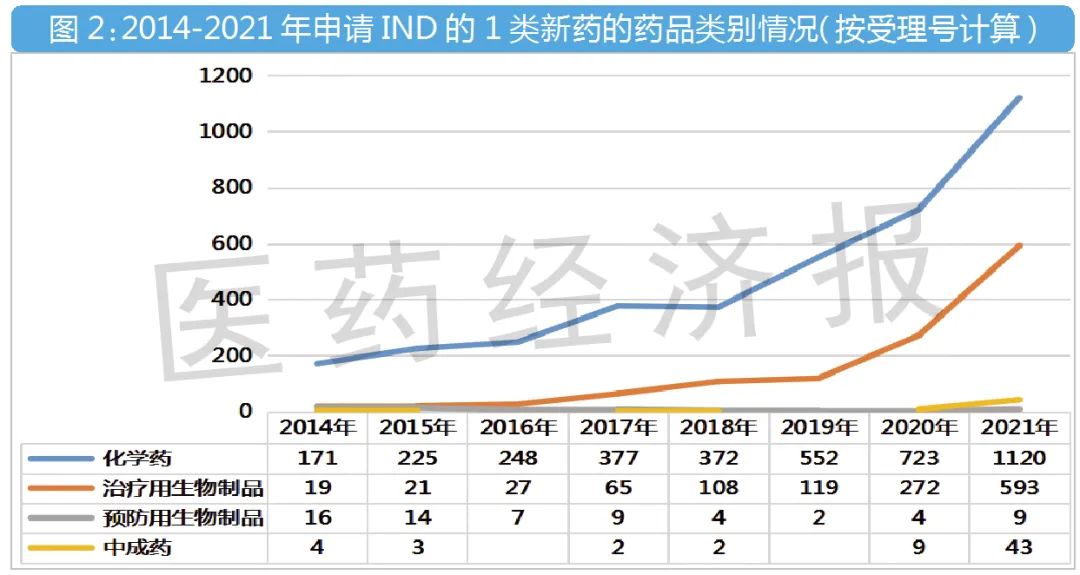
生物药申报数量7年31倍
这主要是受到了大分子药物研发热潮的影响,1类治疗用生物制品IND的申请数量不断增长,受理号从2014年的19个增长到2021年的593个,足足31倍!占比也从9%上升到了33.6%。
04
中成药申报破局,从0到43个
中成药1类新药IND,则是在2020年新修订《药品注册管理办法》正式实施后,才开始打破此前寥寥无几的申请局面,受理号快速增长到2021年的43个,占比为2.4%。
05
以国内企业申报为主,增速加快
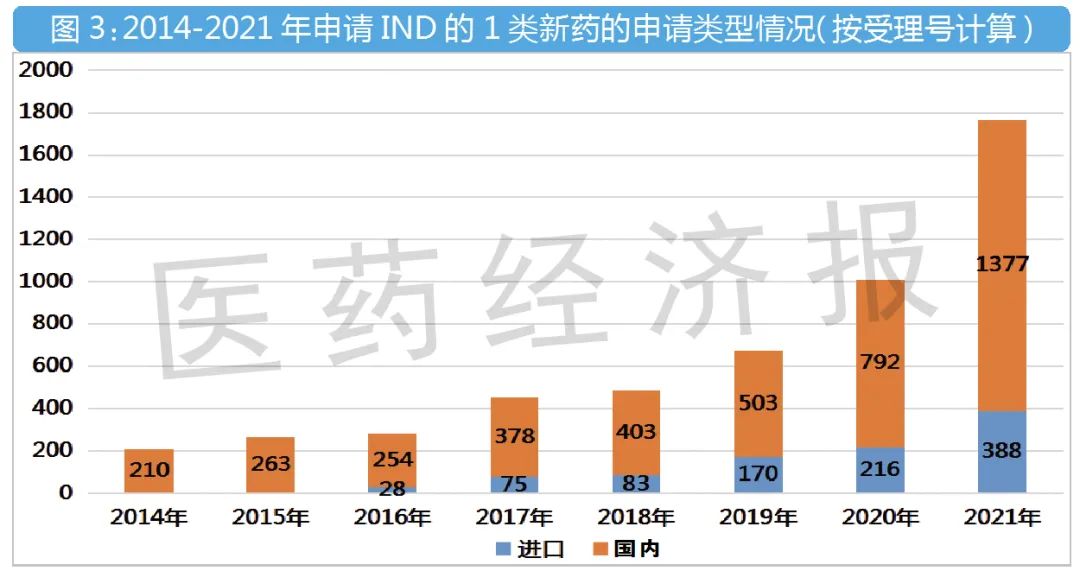
进口的1类新药申请IND数量也在快速增长,2016年仅28个受理号,到2021年就达388个,占比快速上升到22.0%。
06
抗肿瘤和免疫调节剂占近七成
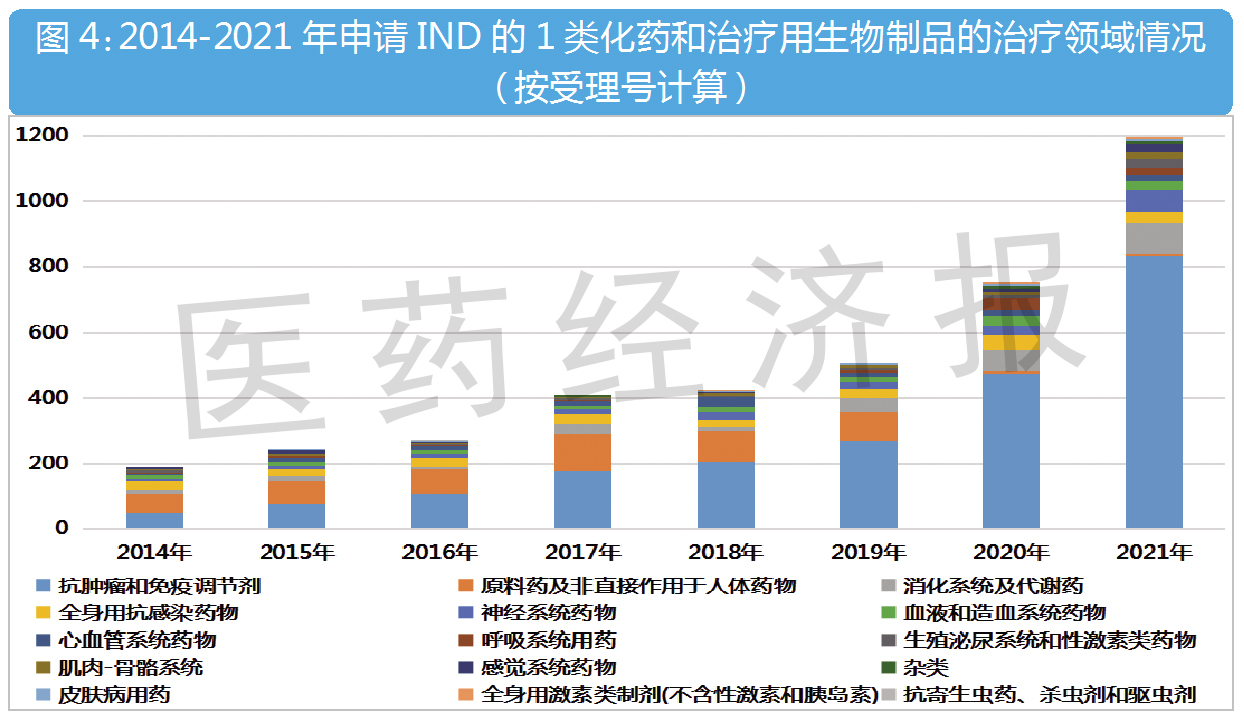
申报IND的1类中成药则以消化系统疾病用药和心脑血管疾病用药为主,2021年分别有9个和7个IND受理号。
07
申报的通用名数量快速增长
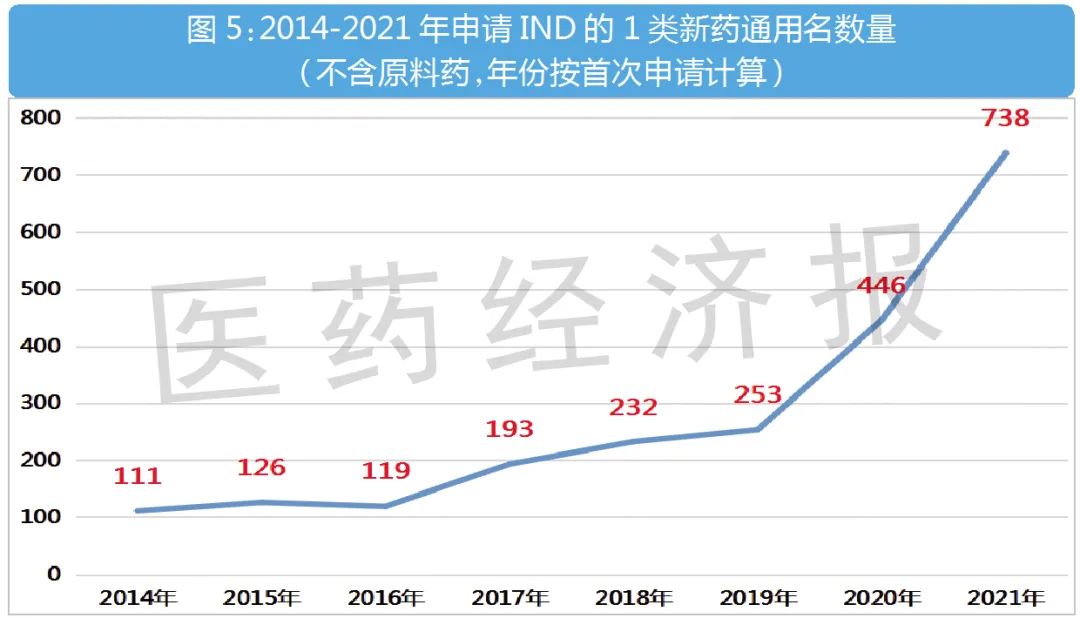
同一通用名的平均受理号增多
近年来,同一通用名申请的受理号数量越来越多。2014年时,平均每个通用名(不含原料药)申请了1.39个受理号;到2021年时,这个数字已经增长到2.39个。
09
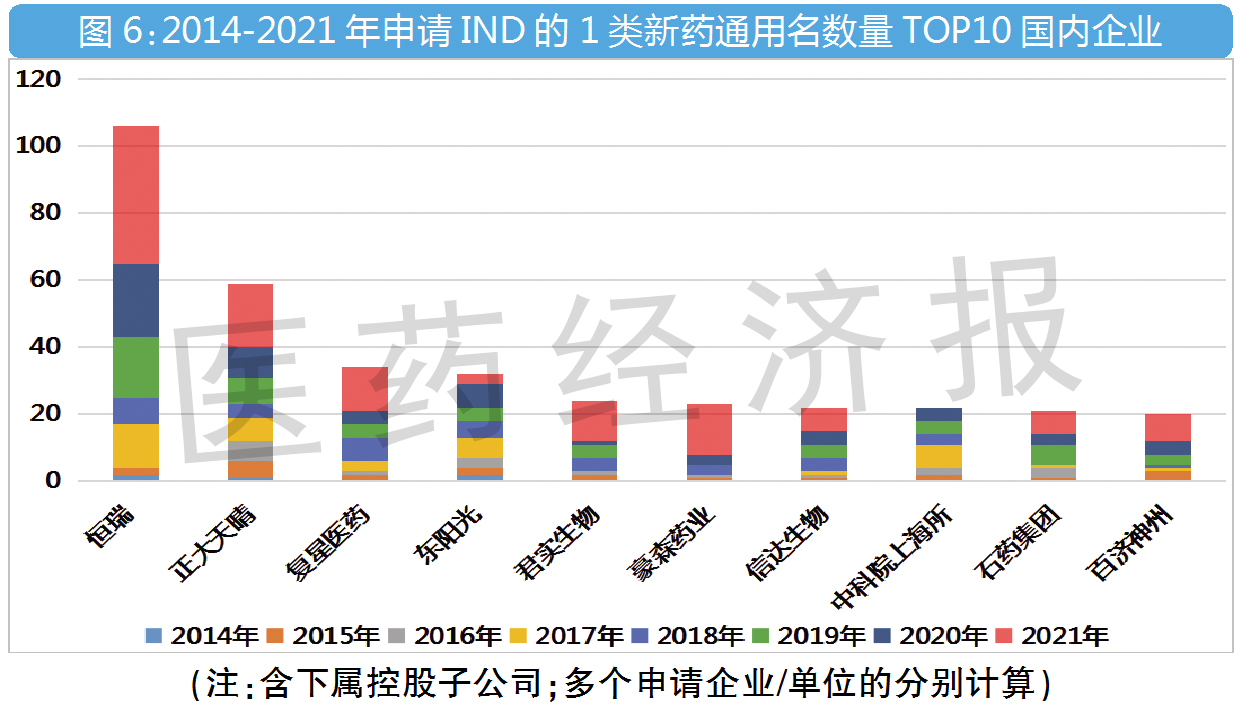
这10家国内企业申请数量最多
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx