为贯彻落实《中华人民共和国药品管理法》等法律法规,2021年9月27日,国家药监局再次公开征求《药品召回管理办法(征求意见稿)》意见(征求意见截止日期:2021年10月29日)。一年前,即2020年10月13日,国家药监局官网发布了一版《药品召回管理办法》(征求意见稿)(征求意见截止日期:2020年10月30日),本文对3版本(2007版、2020版、2021版)的《药品召回管理办法》主要新增修订内容进行了对比分析。
一、解析3版本《药品召回管理办法》基本框架结构变化
2021年版《药品召回管理办法》框架与2020年版完全保持一致,基本框架结构包括总则,药品缺陷的调查与评估,主动召回,责令召回,附则共五章32条,与旧版(2007年版,为2007年12月10日发布并实施)相比,2021年版条款总数减少了8条,第二章节将原“药品安全隐患的调查与评估”修改为“药品缺陷的调查与评估”;不设罚则,原第五章法律责任全部删除;字数都在四千个字左右,建立了新监管时代比较完善的药品召回管理办法。
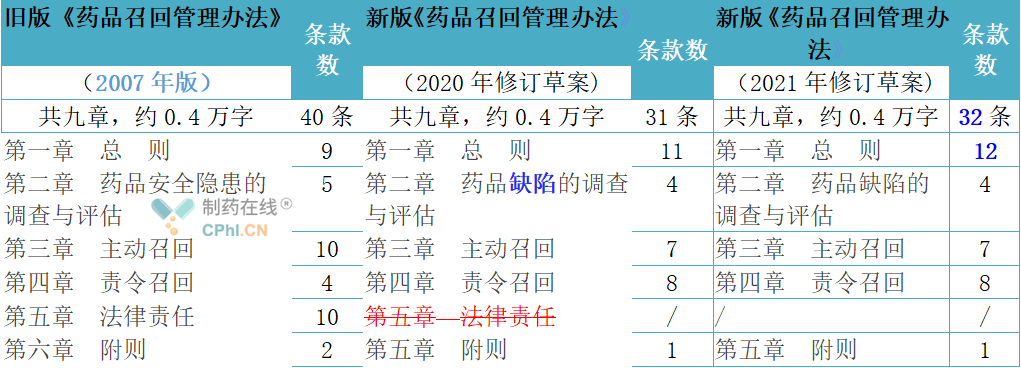
二、3版本《药品召回管理办法》内容变化对照看
新版(2020版和2021版)《药品召回管理办法》修订的亮点包括但不仅限于:落实“放管服”,切实减轻企业负担,突出药品上市许可持有人的主体责任,将“药品生产企业”修改为“药品上市许可持有人”;删除了“包括进口药品的境外制药厂商,将“已上市销售的存在安全隐患的药品”修改为“已上市存在缺陷的药品”,并增加了“并采取相应措施,控制消除缺陷的活动”;将“安全隐患”修改为“缺陷药品”,增加了“销售、储运、标识”等等,有助于提高监管决策的科学合理,3版本(2007版-2020版-2021版)《药品召回管理办法》内容变化对照如下表所示,文章内容蓝色字体为新增或修改的内容,红色字体的含删除线的为已删除的内容:








参考文献
[1]www.nmpa.gov.cn
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx