目前,我国尚无免疫原性研究相关的技术规范,为鼓励和引导规范开展免疫原性相关研究,2021年3月29日,国家药品监督管理局食品药品审核查验中心官网重磅发布《药物免疫原性研究技术指导原则》,自发布之日2021年3月29日起实施。本指导原则成文时间2021年3月5日,药品审评中心由药理毒理学部牵头,于2018年4月启动,2020年3月正式立项,于2020年6月形成初稿,并召开了专家研讨会征求部分业内专家意见;免疫原性研究一直是药物研发之药物评价的一个难点,机理复杂,涉及免疫学、临床医学、药理学、毒理学等多个学科。本文就《药物免疫原性研究技术指导原则》中免疫原性的相关研究进行简单梳理。
一、药物评价的难点——药物免疫原性
药物的免疫原性是指药物和/或其代谢物诱发对自身或相关蛋白的免疫应答或免疫相关事件的能力。随着国内新药,尤其治疗性蛋白药物研究与开发日益增多,免疫原性相关研究越来越广泛,药物免疫原性是抗体药开发过程中一个比较令人困扰的问题,研究内容多,机理复杂,涉及免疫学、临床医学、药理学、毒理学等多个学科,药物免疫原性引起的结果也不好预料,行业政策对它的认知尚在不断的完善。免疫原性检测是药物研发过程中必不可少的一步,需要在临床前和临床阶段均开展,具有免疫原性的药物可能诱发机体产生有害的免疫反应,能形成抗药抗体和中和抗体,前者会引起患者强烈的免疫反应,甚至危害病人生命安全,后者能够中和能力,能够抑制生物药的生物活性而减弱其药效。免疫反应的影响广泛,从无临床意义抗药抗体的暂时出现,到严重危及生命,不必要或非预期的免疫反应可能导致中和药物的生物学活性,或与对应的内源性蛋白产生交叉免疫反应,也可能导致过敏反应和细胞因子释放综合征等不良事件的发生,对患者的安全和药物的有效性均有重要影响。
二、药物免疫原性如何研究?
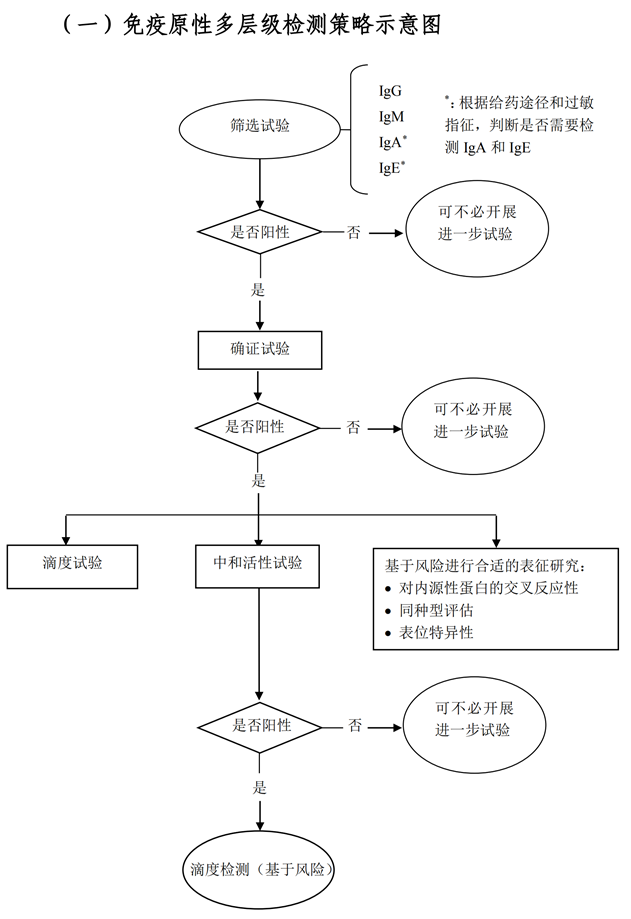
免疫原性研究是基于风险的研究,总结其逻辑顺序为:免疫风险预测、免疫风险识别、以及免疫风险控制。免疫风险识别主要聚焦于抗药抗体的检测,抗药抗体的检测通常应采用多层级分析方法,首先对所有样本进行筛选试验,之后对疑似抗体阳性样本的特异性进行确证试验,对已确证抗体阳性的样本进行滴度试验,以及对抗体中和活性进行检测。其中在已确证抗体阳性的样本中,有时还应考虑对抗体同种型、亚型和结合表位进行检测。免疫原性多层级检测决策树参见检测策略示意图如下:
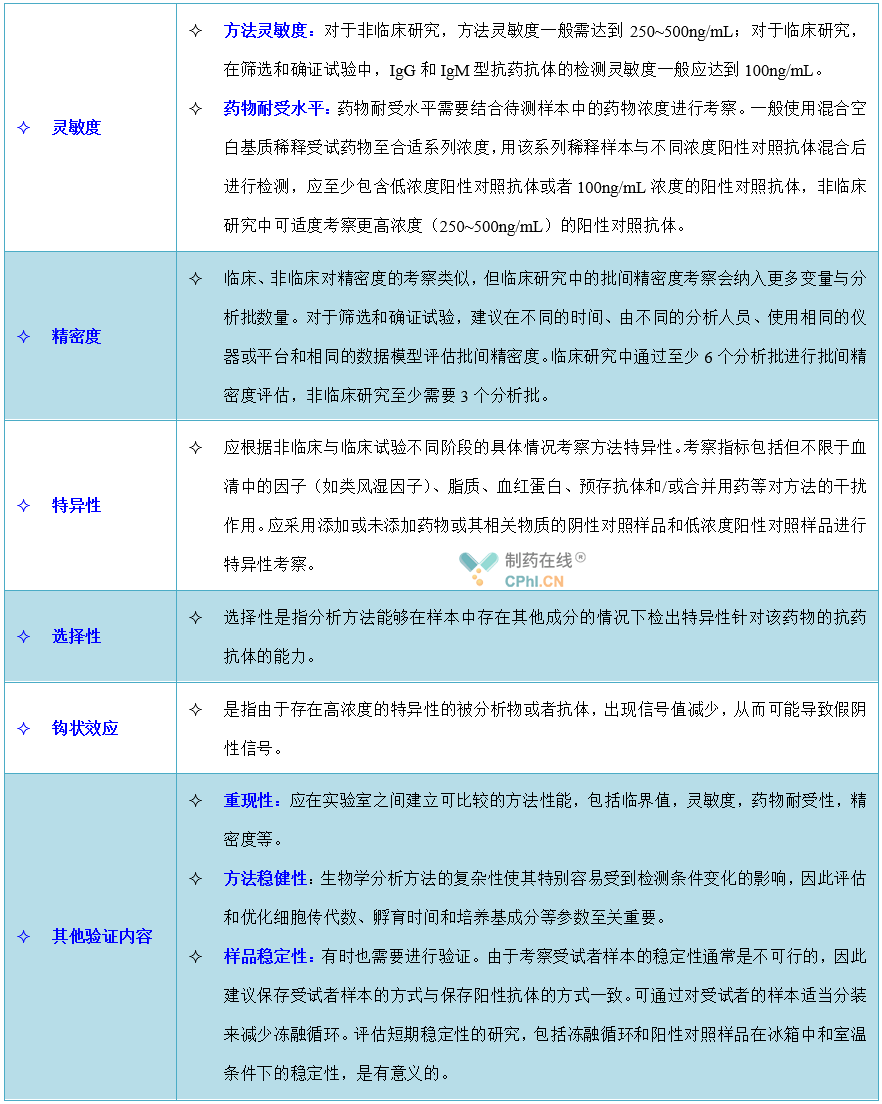
三、抗药抗体检测方法的开发和验证有哪些关注点?

参考文献
[1] www.cde.org.cn
作者简介:滴水司南,男,生物医药高级工程师,立足于生物医药行业质量管理工作,专注于生物医药产业。
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx