东阳光 1 类新药「磷酸依米他韦胶囊」获批上市
发布者:国际药物制剂网
发表时间:2020/12/22 点击:
810
次
12 月 22 日,NMPA 发布通知,东阳光的 1 类新药「磷酸依米他韦胶囊」(商品名:东卫恩)已正式获批。磷酸依米他韦胶囊需与索磷布韦片联合,用于治疗成人基因 1 型非肝硬化慢性丙型肝炎。 依米他韦是东阳光自主研发的 1 类抗丙肝口服直接抗病毒药物(DAA),同时也是东阳光首个报上市的 1 类新药,属于 NS5A 抑制剂。该项目从化合物结构设计、合成,到完成临床前评价,开展I、II、III 期临床试验,均由东阳光自主开发完成。
依米他韦是东阳光自主研发的 1 类抗丙肝口服直接抗病毒药物(DAA),同时也是东阳光首个报上市的 1 类新药,属于 NS5A 抑制剂。该项目从化合物结构设计、合成,到完成临床前评价,开展I、II、III 期临床试验,均由东阳光自主开发完成。
磷酸依米他韦本次获批适应症为:与索磷布韦联用治疗丙肝基因 1 型患者。该方案和国内获批基因 1 型的其他 DAAs 方案相比,拥有中国基因 1 型患者最多的临床试验受试者基数,II、III 期注册临床总计纳入 491 例中国基因 1 型患者,开展了对该人群的有效性和安全性评价。除 II 期研究中 1 例患者因妊娠提前退出研究,1 例患者治疗 8 周提前退出(病毒已转阴),489 例患者整体 SVR12 高达 99.8%(488/489)。我国是肝病大国,根据中国疾病预防控制中心的统计数字,目前中国有 9000 万乙肝病毒感染者,1000 万慢性丙型肝炎感染者。东阳光对乙肝和丙肝这两种我国主要的病毒性肝炎均有布局。在丙肝方面,随着磷酸依米他韦上市申请获受理,另一个与磷酸依米他韦联用的方案 NS3/4A 抑制剂伏拉瑞韦项目也已进展至临床 III 期。在乙肝方面,东阳光自主研发的首个乙肝核衣壳抑制剂甲磺酸莫非赛定,临床 II 期和 III 期试验也在加快推进,当前进度全球领先。Insight 受理号时光轴显示,依米他韦于 2019 年 9 月 12 日报上市,同年 11 月以「具有明显治疗优势的创新药」被纳入优先审评审批程序,今年 12 月进入行政审批阶段。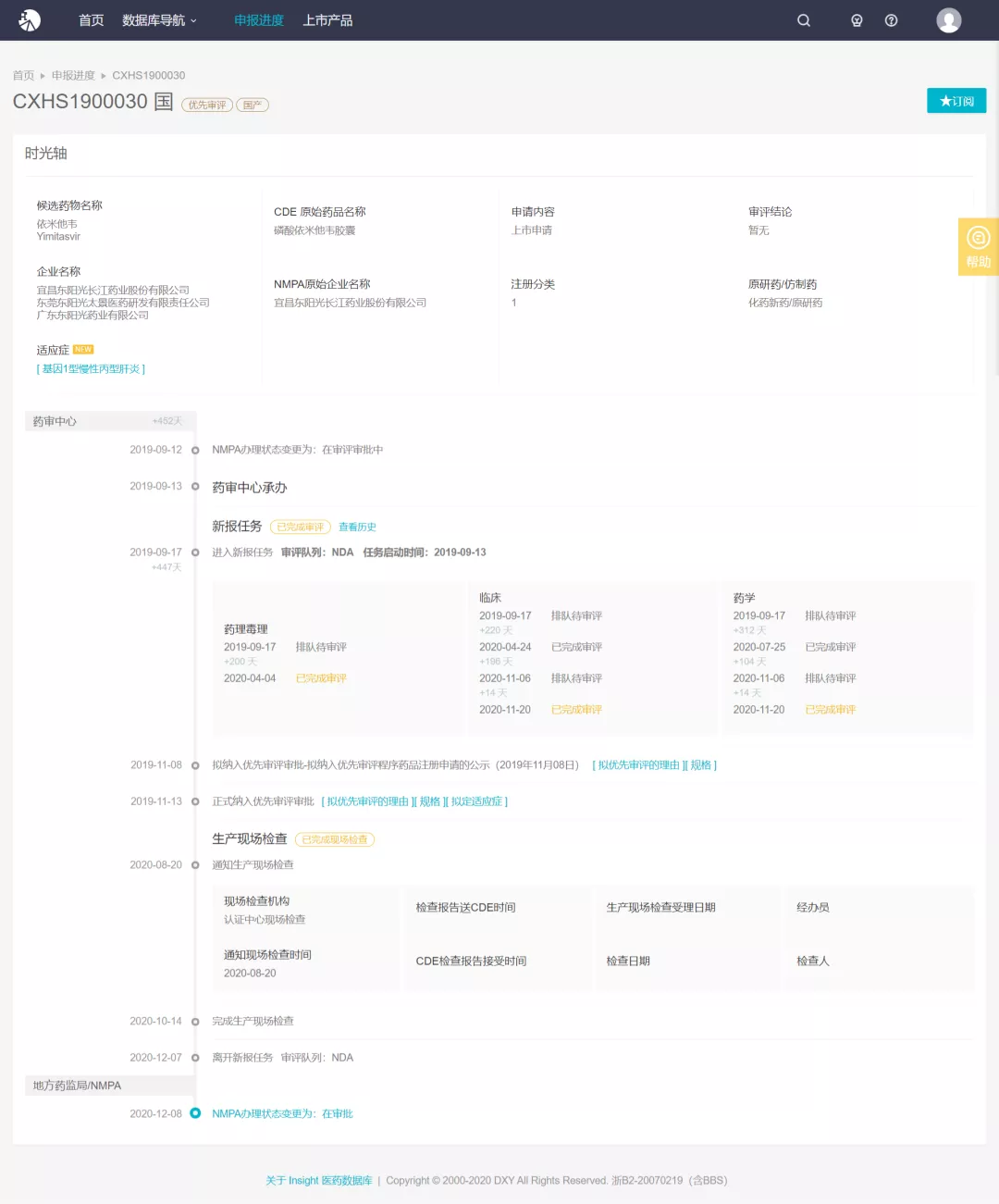 来自 Insight 数据库(http://db.dxy.cn/v5/home/)
来自 Insight 数据库(http://db.dxy.cn/v5/home/)

 来自 Insight 数据库(http://db.dxy.cn/v5/home/)
来自 Insight 数据库(http://db.dxy.cn/v5/home/)