最近,国家药监局发布了药用辅料与药包材的新规,企业的机会来了。
一、 药用辅料、药包材按GMP管理,自2026年1月1日起实施
2025年1月2日,国家药监局重磅发布了《药品生产质量管理规范》药用辅料附录和药包材附录,监管范围全面且详细,堪称我国“史上最严”药用辅料和药包材GMP。
新附录自2026年1月1日起施行。国家药监局在公告中要求,药用辅料、药包材生产企业应当在正式实施前及时改进设施设备并完善质量管理体系,确保符合药用辅料附录、药包材附录的各项要求。

这是2025年开年国家药监局的第一号要文,给企业的准备期只有不到一年的时间了,可谓时间紧、任务重、要求高。
二、药用辅料及药包材的GMP管理非常必要
“齐二药”、“毒胶囊”等药害事件充分表明了药用辅料、药包材对于药品质量的影响,在药品生产过程中使用监管不严的教训是惨痛的,这些事件也直接推动了我国药用辅料及药包材监管制度的完善。
此次国家药监局下发专门的GMP管理文件,更是按药品管理标准严格要求药用辅料及药包材,从而全面推进药品上游产业链建立起药品安全质量风险体系。以此杜绝类似药害事件的发生。
不仅如此,药用辅料生产过程中,如果没有良好的管理规范,也非常容易发生安全事故。
2024年,安徽某药用辅料公司曾发生过一起安全事故,经初步调查,系车间员工清理生产设备罐底浆料时发生意外,造成一名员工失去了生命,而企业也受到经济及名誉上的损失。
随着我国药品监管体系与国际监管体系的融合,尤其是加入ICH(国际人用药品注册技术协调会)并积极申请加入PIC/S(国际药品检查合作计划)后,我国的药品监管政策正在全面与国际接轨。
然而,要实现与国际标准的全面接轨,此前我国对药用辅料和药包材实施关联审评的质量管理方式,难以满足国际组织对于药用辅料和药包材全面监管的要求。
由此可见,药用辅料及药包材实施GMP管理是时代的呼唤,大家纷纷评论,早就应该这样实施了。
三、药用辅料、药包材对药品质量的影响及现状分析
药用辅料的发展直接决定制剂的发展水平,没有优质的辅料不可能生产出优质的药品;没有稳定、均一、安全的辅料不会给药品带来良好的生物等效性。
药包材是守住药品质量的最后一道防线。防菌、防湿、防光、药品与包材之间的相容性等都很关键,需要特别注意的是药品再次被污染的风险。
因此,药包材企业需要确保药包材的生产环境良好,生产工艺安全,产品可靠, 这是药企选择药包材供应商的关键要求,是后续保证药品质量的重要条件。
因此,创新更多的辅料及新型包材满足医药高质量发展的需求尤其重要。
01 药用辅料登记现状
我们国家药用辅料与发达国家的差距依然较大。美国已有激活的辅料3000余种,我国虽然药用辅料登记的数量不少,但是已激活的品种总数仅约占美国辅料品种的十分之一,整体辅料的生产管理水平亟待提升。
目前,我国药用辅料登记了6594个(以登记号计,非品种数量,下同),其中国产占比达73.87%。总计共有3054个已激活,激活比率达46.31%。
以登记号统计,国内药用辅料登记数量,江苏省占比最多,达15.17%,其次是湖南省,占比达13.72%。
图表1:我国药用辅料区域登记占比情况
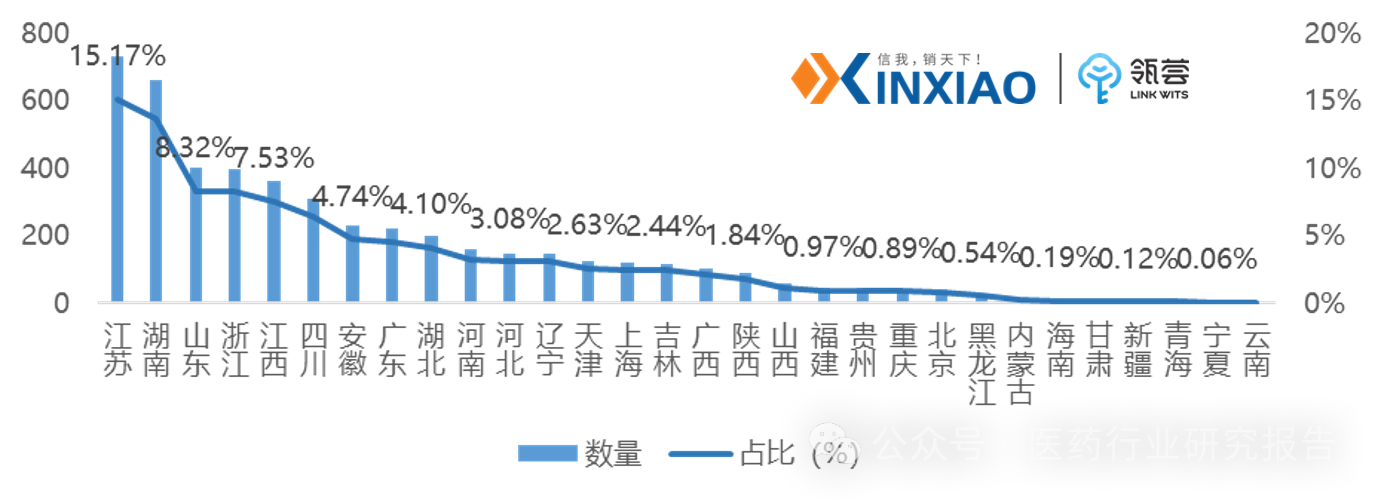
数据来源:CDE,数量以登记号统计,信销行研整理
02 药包材登记现状
目前,我国药包材登记了15262个(以登记号计,非品种数量,下同),其中有7594个已激活,激活比率达49.76%。
以登记号统计,国内药包材的登记数量,江苏省占比最多,达16.17%,其次为广东,占比达11.08%。
图表2:我国药包材区域登记占比情况
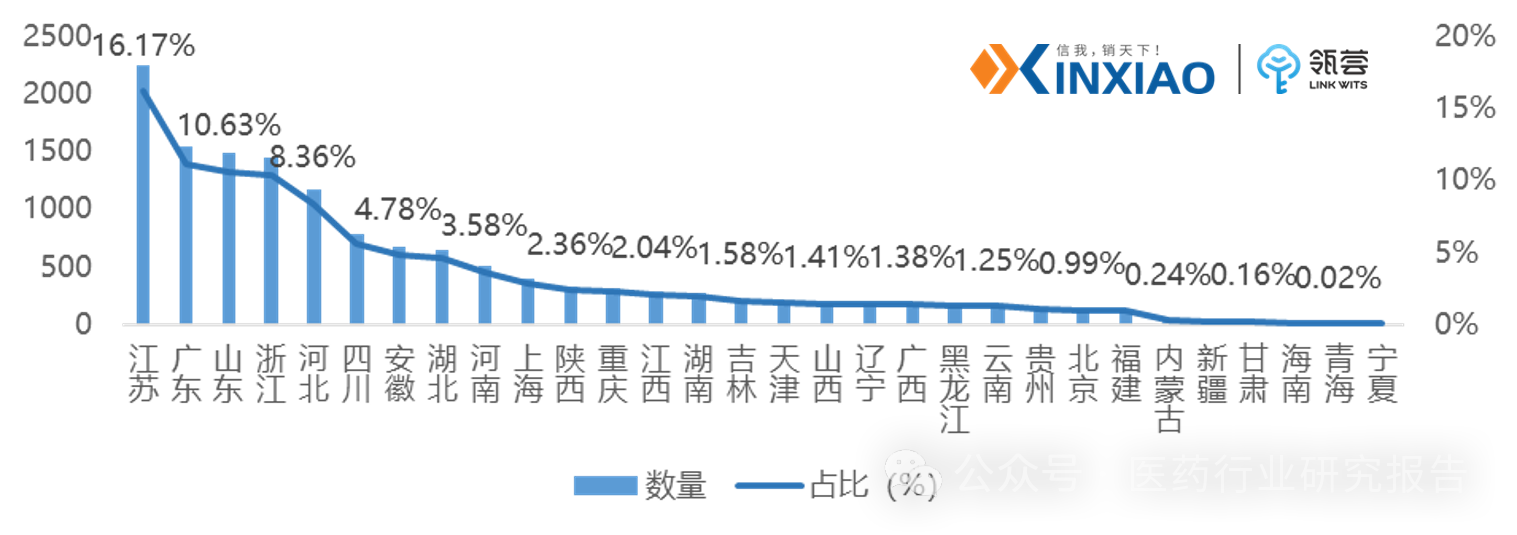
数据来源:CDE,数量以登记号统计,信销行研整理
四、药用辅料及药包材企业如何在风口抢占先机
以药包材附录为例,国家药监局此前发表过相关征求意见稿,但2025年正式发布的文件还是发生了一些变化,尤其强调了人员资质的问题。
要求企业应当配备足够数量并具有适当资质的管理人员和操作人员,各级人员应当具有与其职责相适应的教育背景或者工作经历并经过培训考核,以满足药包材生产的需要。
较2024版征求意见稿,正式版对于生产管理和质量负责人的任职条件作了重大的要求变化,强调了生产实践经验。
总体而言,药包材和药用辅料企业,必须建立健全的质量管理体系。
您可以通过以下方式关注我们:
三、扫描下方的二维码关注我们

【编辑:amanda】 PHEXCOM 本文链接: