为贯彻实施新修订《药品管理法》《疫苗管理法》《药品管理法实施条例》《药品注册管理办法》等法律法规规章文件,落实药品审评审批制度改革要求,完善药品注册体系,加强药品再注册管理,服务、推动医药产业高质量发展,国家药监局组织拟定《关于发布境内生产药品再注册申报程序和申报资料要求的通告(征求意见稿)》。现向社会公开征求意见。
本次公开征求意见的时间为2024年5月13日至6月12日。相关意见请反馈至yhzcszhc@nmpa.gov.cn,并在电子邮件主题注明“单位/个人名称—境内生产药品再注册征求意见反馈”。
附件:1.关于发布境内生产药品再注册申报程序和申报资料要求的通告(征求意见稿)
2.反馈意见表
国家药监局综合司
2024年5月13日

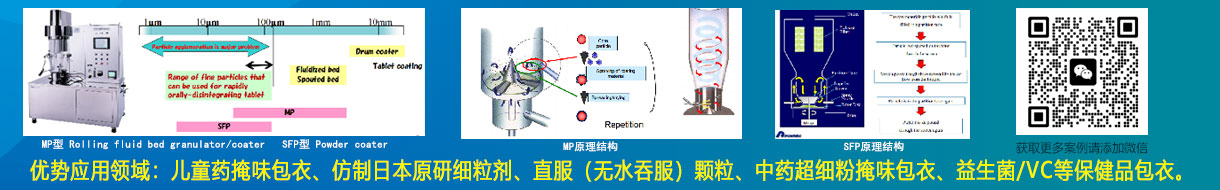
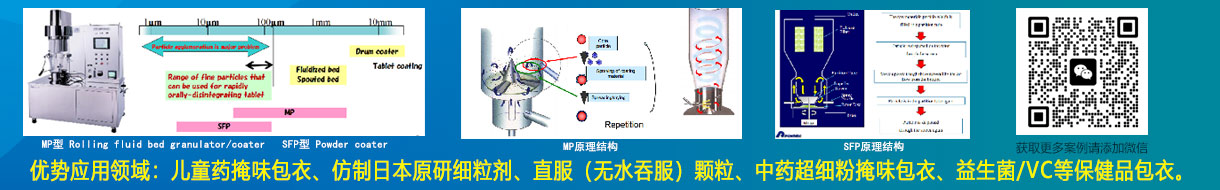







 PHEXCOM公众号
PHEXCOM公众号