长效注射剂的改良与创新:现状与未来
来源(转自凡默谷公众号)
《药学进展》 2025年3月 第49卷第3期
作者
张汶彦,胡鑫蕾,刘莉莎,杨磊,尹莉芳
中国药科大学药学院;
江苏省缓释智能制剂及关键功能性辅料开发与评价工程研究中心
摘要
目前,药品研发领域日益多元化,改良型新药作为重要分支,在提升药物疗效、缩短研发周期及提升市场竞争力方面展现出显著优势。综述了长效注射剂在改良型新药研发领域的现状和发展趋势。文章系统探讨了长效注射剂的制剂开发策略,涵盖油基长效注射液、注射用混悬液、微球、脂质体及原位凝胶等多种剂型,旨在为长效注射剂的改良与创新提供科学依据和参考。
关键词
长效注射剂;改良型新药;创新药;制剂开发策略
1 引言
随着医药科技的不断发展,新药研发领域呈现多元化趋势。相较于探索全新靶点与结构的创新药,改良型新药能够依托已知研究数据,有效缩短临床研发周期,延长药物的生命周期,并激发新的市场竞争活力,正逐步成为医药企业研发的新热点。
当下国家产业政策环境鼓励发展改良型新药,力争实现改良和创新并举。国内正处于从仿制药向创新药、改良型新药转型的过渡期。各类注射剂、缓控释固体口服制剂和口腔速溶膜剂等高端复杂制剂已成为国内改良型新药突破的热点方向。其中,长效注射剂(long-acting injection,LAI)因其独特的临床优势和较高的研究壁垒,正逐渐成为企业改良型新药立项与研发的核心重点。
LAI是指可以在注射给药后较长或指定时间内实现药物持续或受控释放的药物递送系统。此类制剂通常采用皮下或肌肉注射等全身给药方式,也可用于关节内及眼内等局部区域,在单剂量给药后能够提供数周至数月的稳定治疗药物浓度,进而减少给药频次并提高患者依从性。因此,LAI在慢性及重大疾病的治疗中颇具优势,已广泛用于激素类、精神类和戒毒类药物的制剂改良。
随着制剂技术的迅速发展,LAI经历了从油溶液到微球(microsphere)、脂质体(liposome)和原位凝胶的变化,体现了从无到有、从简至精的演变过程。例如,利培酮通过多次剂型优化,从普通片剂转化为微球LAI、原位凝胶LAI,既满足了临床需求,又延长了产品的生命周期,展现出巨大的市场价值,成为国际市场上改良型新药的典范。LAI作为仿制药向改良型新药转型必须跨越的技术门槛,将成为我国制药行业构筑核心竞争力的战略工具,并为我国制药行业的国际化铺设了一条高效且富有前瞻性的加速通道。本文综述了LAI的制剂策略,旨在为LAI的深度开发提供参考与启示。
2 长效注射剂的研发策略
LAI的设计旨在通过不同的制剂策略延长药物在体内的停留时间,从而实现持续的药物释放。这些策略包括但不限于油基LAI、注射用混悬液、微球、脂质体以及原位凝胶。每种制剂策略都有其独特的药物释放机制(见图1),能够满足不同的临床需求。以下将详细介绍这些LAI的制剂策略,分析其原理、制备方法以及在临床应用中的表现,并探讨各类LAI在药物递送中的应用前景和研发难点。
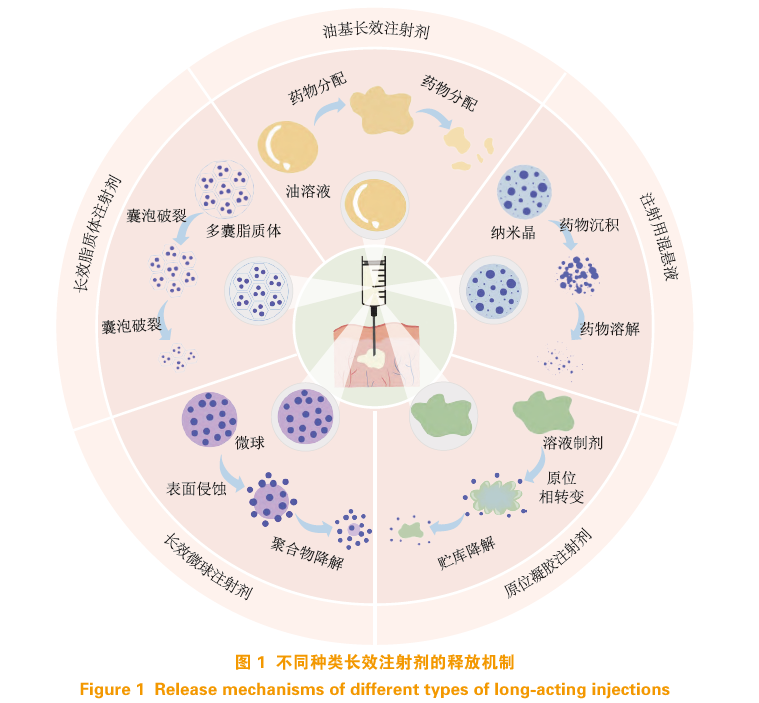
2.1 油基长效注射剂
油基LAI是将药物溶解或分散在油性溶剂中得到的制剂。传统上用于治疗需要长期用药的慢性疾病,如精神分裂症等。油基LAI通常通过肌肉或皮下注射给药,并在注射部位形成药物贮库,将药物缓慢释放到周围血液中。其缓释机制主要依赖于油性载体在注射部位的缓慢分解和药物在油水之间的分配。
油基LAI通常由亲脂性药物、油性载体和共溶剂组成。还可以使用助溶剂降低油系统的黏度,同时增加药物的溶解度,苯甲醇是最常用的共溶剂。此外,可将固体药物颗粒分散在油性载体中以提高载药量。
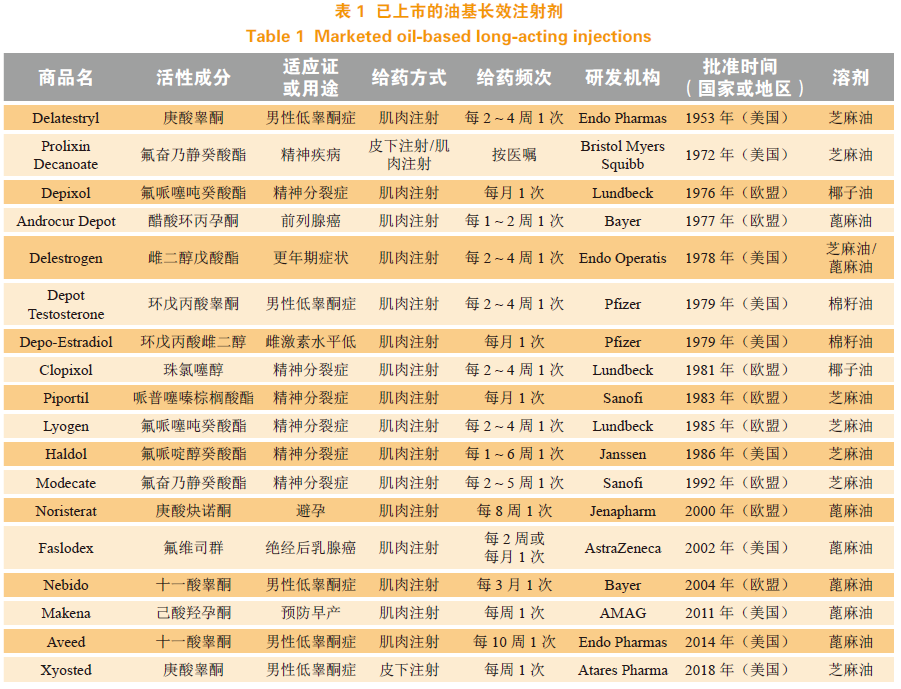
油基LAI是最早使用的LAI剂型,目前已批准上市的油基LAI见表1。
目前,油基LAI的研发难点主要集中在:药物在油相中的溶解度和稳定性、注射部位的不适感和药物释放的调整。油相的合理选择对解决以上问题至关重要。黏度是选择油性载体的关键参数,直接影响制剂的扩散程度和可注射性。具体而言,高黏度油能更好地保持制剂注射后的形状,从而减少扩散并延长药物释放时间;而低黏度油则具有良好的可注射性,可以降低注射过程中的疼痛与不适感。通常情况下,黏度在60mPa·s以下的牛顿流体油溶液的可注射性较好,上市的注射剂产品黏度一般在29~60mPa·s范围内。除黏度外,药物在油和组织液之间的分配、注射部位、注射量以及注射部位的制剂形状等因素也会影响药物的整体药代动力学特征。
尽管该系统具有良好的长期稳定性和快速简便的制备工艺与灭菌流程,但其缓释时间通常不超过4周,且仅能用于递送亲脂性药物,还可能引起注射部位的不适感及不良反应。因此,在探索该缓释系统的潜力时,需充分考虑其特定的药物适应性及安全性问题。
2.2 注射用混悬液
注射用混悬液是一种通过减小药物粒径增加表面积,以增加药物溶解度、实现长效递送的制剂。根据粒径大小,注射用混悬液可分为微米晶(0.5~15μm)混悬液和纳米晶(100~600nm)混悬液。对于同种药物,一般药物颗粒的粒径越大,其缓释作用越强。
注射用混悬液通常包含活性药物成分(API)、分散介质和稳定剂三部分,此外,处方中还可加入渗透压调节剂、pH调节剂等辅料以满足制剂安全性、有效性、稳定性、顺应性的需求。用于注射用混悬液的药物通常是水溶性差、亟需提升溶解度与生物利用度的药物,比如某些难溶性的抗癌药物、抗生素和激素类药物。稳定剂包括助悬剂和润湿剂,常使用表面活性剂和高分子聚合物,用于润湿药物,增加分散介质的黏度,减缓药物微粒的沉降,阻止药物微粒聚集结块。
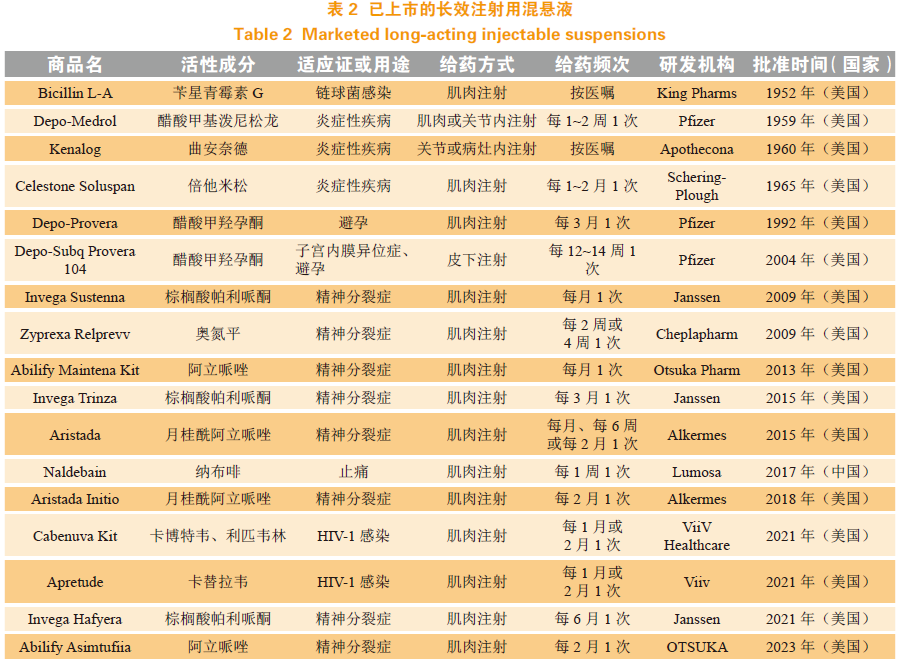
注射用混悬液给药后能够在注射部位沉积,随后药物缓慢溶解并吸收入血。在这一过程中,少量已溶解药物和较小粒径的药物颗粒能被快速吸收而发挥药效,较大粒径的药物颗粒渐进性溶解成较小颗粒,持续不断地被吸收入血。不同粒径的药物协同作用,确保了药物在体内的长期稳定释放。目前已有多种注射用混悬液产品上市(见表2)。
相较于其他LAI,注射用混悬液因辅料体系简单、工业生产便捷而受到科研界与产业界的广泛关注。然而,注射用混悬剂普遍存在药物释放周期较短、制剂体系稳定性较差等问题。当前针对注射用混悬液的研究主要集中于三大核心领域:一是优化药物释放性能;二是提高制剂体系的稳定性;三是粒度控制。粒度是关键质量属性,精确控制粒径分布范围对于优化药物释放和提高稳定性均有重要作用。
增加药物的亲脂性、改变粒径和浓度可以延长药物释放时间。Kenalog®的活性成分曲安奈德是曲安西龙的亲脂性衍生物,其低水溶性使得曲安奈德混悬液在体内的作用时间更长。上市产品中,Invega Sustenna®和Invega Trinza®通过调整粒径和浓度实现了不同缓释时间。
注射用混悬液中颗粒有时会发生奥斯特瓦尔德熟化,导致重结晶和沉淀,影响注射和释放行为。使用稳定剂可以防止纳米晶体的聚集和重结晶,保持其粒径尺寸和分散性。
2.3 微球
微球是将固体或液体药物分散或溶解在聚合物材料中形成的微小球形颗粒,大多由生物可降解聚合物制成,可以在体内逐渐降解,最终被代谢排出体外。微球的尺寸通常在10~250μm范围内(理想情况下为10~125μm),以便通过传统注射器针头注射,并减少巨噬细胞的吞噬作用和局部组织炎症。
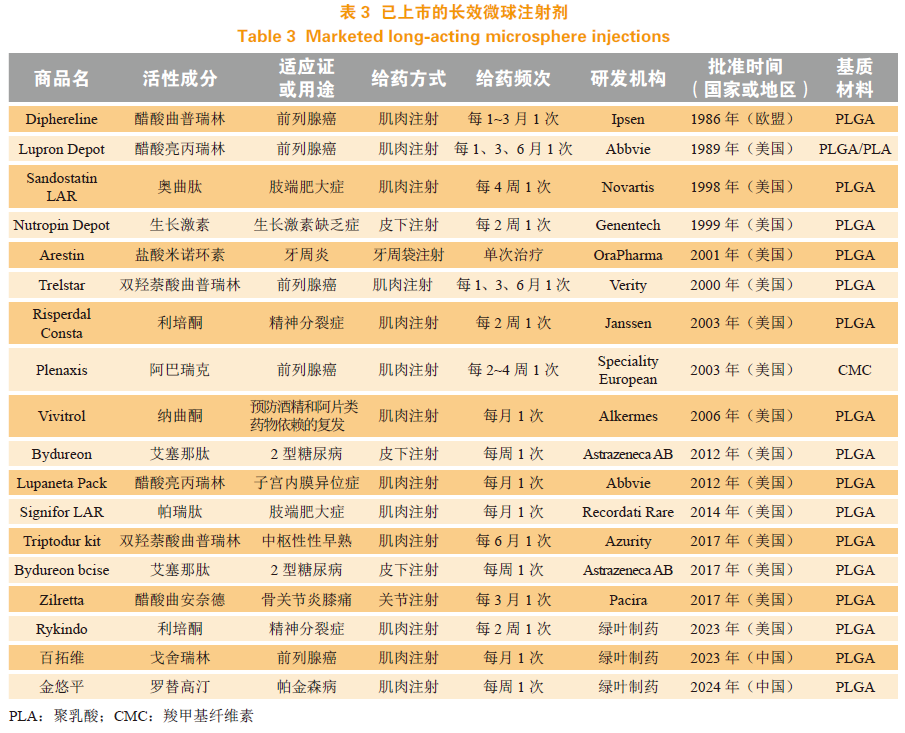
微球的释药机制主要包括扩散、溶解以及聚合物的侵蚀和降解。具体来说,药物释放途径包括表面释放、孔隙释放、聚合物屏障扩散、水溶胀屏障扩散,以及聚合物的侵蚀和降解5种。一般而言,基于聚乳酸-羟基乙酸共聚物(PLGA)的微球药物表现出3个释放阶段:突释、缓释和二次突释。近年来,已有多种微球制剂成功上市或申报新药审批,目前已批准上市的长效注射微球如表3所示。
目前,关于微球的研究主要集中在制备技术、处方优化、新型材料和药物释放调控等方面。经典的微球制备方法工业化生产难度大、成本高,Nutropin®和Plenaxis®皆因生产成本问题退出市场。近年来,微流控技术、超临界流体技术等新型制备方法相继出现,研究者们不断研发与优化各类新型技术,以期实现微球制备过程的高精度控制、高效率生产和多功能化集成。
在处方优化方面,选用不同种类和比例的辅料,可以显著提高微球的药物稳定性和生物利用度。Park等研究了不同添加剂[碳水化合物、蔗糖、氨基酸、表面活性剂、泊洛沙姆188、磷脂和二肉豆蔻酰磷脂酰胆碱(DMPC)等]对W/O/W-溶剂蒸发法制备的多肽微球稳定性的影响。结果表明,不同的稳定剂可以从水溶液、水/二氯甲烷界面、PLGA表面和冻融冻干过程等不同方面调节多肽微球的稳定性。
除PLGA之外,研究人员开发了其他具有相似生物相容性和药物释放控制能力的聚合物,如聚[1,3-双(对羧基苯氧基)丙烷-癸二酸](PCPP-SA)、透明质酸(HA)、三(乙二醇)-聚(邻酯)(TEG-POE)等,这些材料可用于装载与PLGA不相容的药物。
2.4 脂质体
脂质体是基于胆固醇和天然磷脂的球形囊泡,能包裹药物并实现长效释放和定向递送。根据粒径和脂质双层膜数量,脂质体主要可分为单室脂质体(ULV)、多层脂质体(MLV)和多囊脂质体(MVL)等。脂质体中药物的缓释效果取决于脂质体的大小、结构、表面电荷和脂质组成。注射后,制剂在给药部位形成贮库或在循环系统中稳定存在,实现药物持续释放。
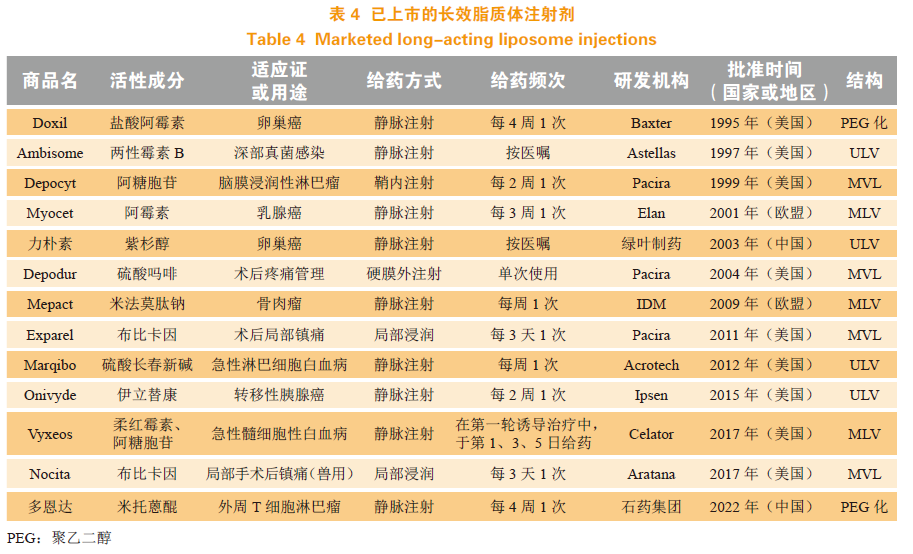
Doxil®是首个获美国FDA批准的注射用脂质体,运用Stealth技术实现长循环并缓释盐酸阿霉素。而MVL基于其多隔室结构,为实现更长的药物缓释时间提供了一种有效策略。DepoFoam®技术是由Pacira公司开发的MVL技术。MVL由数百个非同心、多面体的水室组成,每个室由连续的脂质膜网络隔开,可通过鞘内、皮下等多途径注射给药,并在给药部位形成贮库,通过最外层囊泡的逐渐降解实现持续药物释放。在囊泡重排过程中,MVL的结构保持不变。目前已有3个基于DepoFoam®技术的药品获得FDA批准上市。目前已批准上市的长效脂质体注射剂见表4。
目前长效脂质体注射剂仍面临药物装载效率、稳定性、工业化生产和药物释放控制等方面的多重挑战。优化生产方法和工艺步骤,并保证脂质体的均匀性和药物装载效率,是当前研究的重点。Costa等基于乙醇注入法,结合连续混合、流动和过程分析技术(PAT),通过将溶有脂质的有机溶剂与水溶液分别以特定流速注入混合器形成脂质体,显著提高了脂质体的生产效率和质量一致性,同时证明该方法适用于大规模生产。Yanar等基于微流控技术,使用毫米级流动反应器在连续流动条件下生产脂质体,并证明优化流体条件可以提高脂质体的尺寸均匀性和分散性,从而提升药物递送的效果。
由于脂质体的内部空间受限,保证药物稳定性的同时提高装载效率是另一个难题。通过调整脂质成分和工艺条件,可显著提高药物装载效率和稳定性。Pereira等研究了不同脂质组成对脂质体包封效率的影响。结果表明,使用流动性较高的不饱和脂质制备的脂质体具有最高的包封效率,而使用刚性饱和脂质制备的脂质体包封效率较低。
2.5 原位凝胶
原位凝胶是一种能在注射部位自发形成凝胶状药物贮库的可生物降解聚合物基液体或可注射半固体制剂。相较于嵌入体内指定部位的植入物系统,原位凝胶因其生物相容性好、患者依从性高和易于产业化而被青睐。
原位凝胶通常由API、溶剂和能形成贮库的基质材料制成。常用的溶剂包括N-甲基吡咯烷酮(NMP)、二甲基亚砜(DMSO)和苯甲醇等有机溶剂,基质材料通常为水不溶的生物可降解材料,如PLGA、PLA、聚己内酯(PCL)、乙酸异丁酸蔗糖酯(SAIB)和聚原酸酯(POE)等。根据制剂组成,原位凝胶可以通过沉淀(由溶剂交换、温度或pH诱导所致)、有机凝胶化(涉及溶致液晶形成)或单体/聚合物链的交联(由光照射、离子或酶等触发)形成原位贮库。其中,溶剂交换诱导的原位沉淀是目前研究最广、上市品种最多的原位凝胶形成方式。该方法通过将药物溶解或分散在溶有基质材料的有机溶剂中形成制剂。注射后,制剂与周围环境发生溶剂交换,使基质材料沉淀并形成固体或半固体贮库,实现药物缓慢释放。
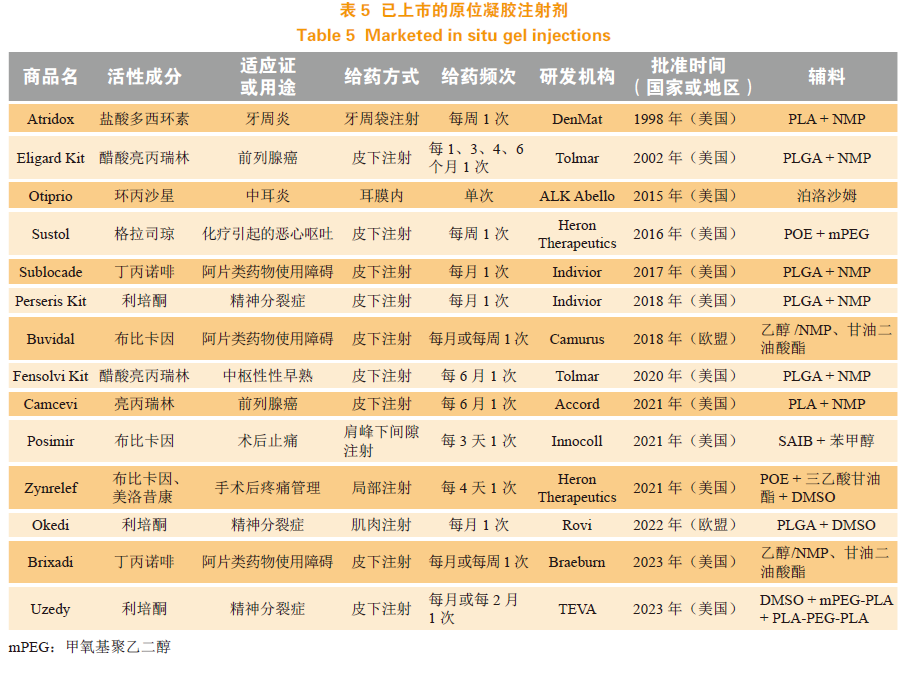
目前已上市的原位凝胶产品主要依托于以下几项技术:基于PLGA和PLA的Atrigel®技术、基于POE的BiochronomerTM技术、基于SAIB的Saber®技术、基于溶致液晶系统的FluidCrystal®技术,以及基于PEG-PLA嵌段共聚物的BEPO®技术。其中,由Camurus公司开发的FluidCrystal®是由一定浓度的两亲性分子与适宜溶剂混合形成的低黏度液晶前体,注射后与体液接触发生相变而形成高黏度的以凝胶形态存在的半固体液晶结构——溶致液晶凝胶。基于该技术的药物Brixadi®已被FDA和欧盟批准上市。目前已获批准上市的原位凝胶注射剂见表5。
与其他LAI相比,原位凝胶的制造过程简单可控,更适合工业化生产。但其开发中仍面临药物突释风险、制剂安全性和贮库形成控制等问题。
原位凝胶的释放曲线通常是双相的,包括突释和缓慢释放阶段。突释阶段通常被认为是凝胶贮库形成前药物扩散引起的。影响突释的因素包括基质材料的性质、基质材料和溶剂与药物的相互作用以及药物本身的水溶性与晶型等。缓慢释放阶段则通过固化或半固化的基质材料释放药物,是药物扩散和基质材料降解作用的结合。Cao等探索了不同溶剂对溶剂交换原位贮库系统释药速率的影响。结果显示,不同溶剂对突释有显著影响,DMSO(24.21%)<乙醇(36.85%)<NMP(42.23%)。这种差异主要归因于药物在不同溶剂中的溶解度和溶剂的扩散速率不同。此外,注射后体内贮库的形态也显著影响药物的释放行为。
3 长效注射剂发展面临的挑战
3.1 高技术壁垒与市场垄断
LAI的研发涉及复杂的制剂技术,包括药物与辅料选择、载体设计、工艺优化和质量控制。目前制剂关键技术多被国外企业所掌握,一些跨国制药公司拥有多项LAI核心专利,通过专利保护和品牌优势形成市场垄断,影响药物价格并抑制创新,导致新药物和新技术的推出速度减缓,从而限制了国内药企在这一领域的技术进步。此外,LAI的生产需要特殊的设施和设备,如无菌生产环境和高级的药物释放检测仪器,增加了小型企业的研发投入成本。功能性辅料的垄断现状进一步加大了LAI开发成本和难度,以常用辅料PLGA为例,其市场主要由国外供应商如Evonik和Corbion等占据。这种垄断导致国内企业面临高昂的价格问题和供应链中断的风险。因此,实现辅料供应链的自主可控,开发高质量国产药用辅料,对于提升国内LAI的研发能力至关重要。
3.2 体外释放方法的复杂性和局限性
随着LAI制剂形式的多样化,不同的给药途径(如肌肉注射、皮下注射)以及制剂参数(如粒径、表面特性、聚合物降解速率等)都可能会影响药物在体内的释放方式和速率。因此,体外释放方法应根据具体的制剂特性和给药方式进行个性化调整,以确保释放模式的准确性和临床相关性。各国药典和相关指导原则尚未提供广泛适用的标准化评价方法。目前,较多使用的体外释放方法包括桨法和流通池法等,这些方法虽然适用于特定类型的LAI,但仍存在局限性。例如,桨法虽然易于操作,但难以有效模拟注射剂在体内复杂环境中的释放行为;而流通池法在一定程度上模拟了体内条件,但在长期研究中可能出现设备组件故障。监管机构批准的其他非药典释放方法如透析袋法、转瓶法、摇床法等受设备参数调整影响大,设备参数偏差可能掩盖药物释放行为的真实差异。
理想的体外释放方法应具有良好的区分力和重复性,并与体内释放行为相关。因此,针对不同制剂形式的特性,开发出能够精确控制和重复模拟LAI体内贮库形状的释放方法,将有助于提高LAI的研发效率和临床应用效果。
3.3 体内外相关性缺乏
LAI体内外相关性(IVIVC)的建立在其研发中具有重要意义。基于LAI注射后体内行为的复杂性,目前缺乏通过体外释放预测体内过程的可靠模型,需要通过大量动物实验来探索体内释药机制。这不仅增加了研发难度,也对动物福利提出了挑战。建立合适的体外释放方法,构建可靠的IVIVC预测模型,也是LAI领域亟待解决的问题之一。
近年来,针对LAI的IVIVC研究已有一定进展。许多新型模型和方法的开发为IVIVC的建立提供了新的方向。例如,Bibi等通过生理药代动力学(PBPK)模型预测了人体内的药物行为,为后续研究提供了新思路。Gan等利用基于生理的纳米载体生物药剂学模型预测了阿霉素脂质体的临床表现,展示了新模型在提高IVIVC方面的巨大潜力。Malavia等开发了一种新型样品保持适配器,通过模拟LAI注射后在体内形成的药物贮库结构,显著提高了体外试验的临床相关性和可重复性。FDA也在积极探索这些建模与模拟方法,以支持LAI的临床开发和监管决策。整体来看,IVIVC在LAI药物研发中的指导作用日益增强,未来在药物开发和监管过程中将扮演更加关键的角色。
4 结语与展望
通过技术创新和工艺优化,LAI在提升药物稳定性、减少给药频次等方面已取得了显著成效,极大地改善了患者的治疗体验和生活质量,为改良型新药的研发提供了新方向。然而,LAI的发展也面临着诸多挑战,如工业生产的复杂性、体内外相关性的验证难度大以及研发成本高昂等。因此,需要更加注重跨学科合作,将基础研究、产品开发、工艺优化和临床研究等多领域资源紧密结合,形成协同创新机制,加速LAI的研发进程和成果转化。未来,政府的政策引导、资金投入和监管指导将为LAI的研发提供坚实保障;新型辅料的不断涌现、制造工艺的持续创新、智能化药物递送系统的研发及个性化医疗的深化,也会为LAI的改良提供更多可能性。
参考文献
详见《药学进展》 2025年3月 第49卷第3期
您可以通过以下方式关注我们:
三、扫描下方的二维码关注我们

【编辑:amanda】 国际药物制剂网 本文链接: