国产他汀研发立项决策当下
SFDA药品审评中心化药临床二部 谢松梅 王涛 华尉利
辉瑞的他汀药专利到期在即,仿制机遇就在眼前。近年来,国内外诸多医药企业不断从事他汀类药物的研发,是创新、是改剂型、是新适应症还是纯粹仿制?
他汀类药物(statins),即3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methyglutaryl-coenzyme,HMG-CoA)还原酶抑制剂。大量基础研究和临床试验显示,他汀类药物不仅具有强大的降脂作用,还具有独立于其降脂作用之外的“多重效应”,如:改善血管内皮功能、抑制炎症和抗氧化反应、抗血小板聚集和抑制血栓形成、稳定粥样硬化斑块、抑制心肌细胞重塑和心肌细胞凋亡、抑制心脏电生理重塑和调节心脏植物神经功能等一系列作用。4S研究、CARE研究、LIPID研究等大规模临床试验结果显示,一些他汀类药物在迅速降低异常高的血浆总胆固醇(TC)水平的同时,可显著降低冠心病发病率、死亡率、降低总死亡率,在冠心病的一级预防和二级预防中发挥了重要作用。因此,他汀类药物的出现是心血管疾病治疗史上一个重要的里程碑,并成为目前临床上用于治疗各类高脂血症、防治动脉粥样硬化及冠心病的主力血脂调节药物,也是全球医药市场著名的“重磅炸弹”级药物。
近年来,国内外诸多医药企业不断从事他汀类药物的研发,包括创新药、新剂型、新适应症、仿制产品等,本文对我国2005年1月1日至2010年6月30日期间的调脂药物(主要是他汀类药物)的注册申报和审评建议批准的情况进行统计分析,为国内该类药物的研发立项决策提供参考。
选择国家食品药品监督管理局药品审评中心(以下简称CDE)技术审评系统的调脂药物,主要是他汀类药物的注册申请为研究对象,以受理号统计申报受理及批准的数量,具体品种(如辛伐他汀、阿托伐他汀等)的数量为该品种原料和制剂数量的总和。
数据显示,2005年1月1日~2010年6月30日期间,CDE接收的他汀类药物申报数量占所有调脂药物申报总量的90.14%(640/710),其中申报临床试验的占91.16%(454/498),申报生产的占87.74%(186/212)。他汀类药物成为调脂类药物的最为主要的申报对象。
2005年1月1日~2010年6月30日期间,他汀类药物按年代及申报、审评建议批准情况进行分类的数量统计见表1。
国企: 仿制为主 缺乏创新
从表1数据分析,①申报情况:2005年1月1日~2010年6月30日期间,他汀类药物总申报量较大。各年申报量中,2005年达高峰(以临床申请为主,占90%),2006年后申报量明显下降。②批准情况:因审评时间与申报时间不同步,故表1中申报和批准数量不能用以直接对比,但可看出,2005年1月1日~2010年6月30日期间,他汀类药物批准以2005年及2006年批准量较大,2007年后批准量明显下降。③国产和进口申报、批准情况:仍以国产品种为主,其申报和批准量分别占总申报量和总批准量的92.81%和94.12%。
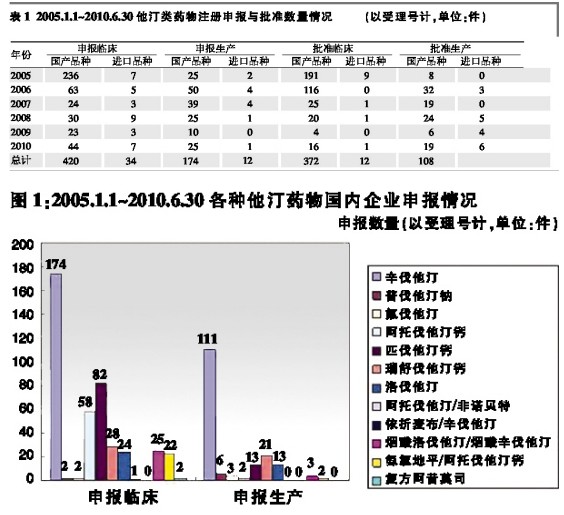
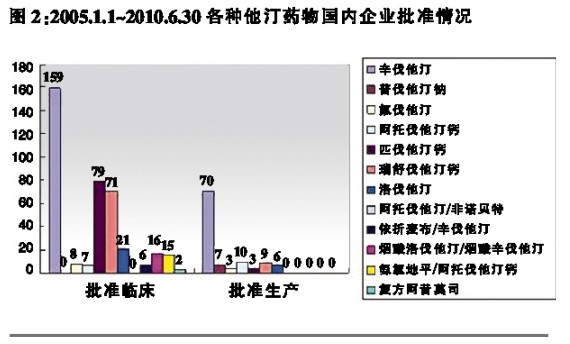
2005年1月1日~2010年6月30日期间,各种他汀类药物由国内企业申报及批准的具体情况见图1、图2。
图1、图2数据显示,①2005年1月1日~2010年6月30日期间,国产他汀类药物申报和批准临床的总量分别为420件和384件,其中以辛伐他汀申报量和批准量最大,分别占申报临床总量和批准临床总量的41.43%和41.41%;总体以单方制剂为主;②2005年1月1日~2010年6月30日期间,国产他汀类药物申报生产和批准生产的总量分别为174件和108件,其中仍以辛伐他汀申报量和批准量最大,分别占申报生产和批准生产的总量的63.79%和64.81%;申报生产的他汀类药物以单方制剂为主,无复方制剂获准生产。
此外,2005年1月1日~2010年6月30日期间,国内企业申报和批准的他汀类产品以仿制药为主,如:申报生产品种中,新药申报数量共计53件,均为注册分类3或注册分类5的品种,无创新产品的申报。而申报生产的仿制产品则共计121件。
[申报现状及存在问题]
仿制为主,缺乏创新
以仿制为主,新药主要集中在注册分类3和注册分类5的品种,而注册分类1的产品仅有2个,分别为阿昔莫司/辛伐他汀缓释片和阿昔莫司阿托伐他汀钙控释片,均属于注册分类1.5的品种,目前处于临床试验阶段。尚无创新的他汀原料和/或单方制剂的申报。从他汀类产品申报和批准情况可看出,国内他汀药物研发多参照国外新的他汀类药物研发申报和批准情况进行,国内同种他汀药物研发申报和批准时间多滞后于国外进口新产品。
简单改剂型品种大量申报
剂型国内改剂型多为由片剂或胶囊改为如分散片等其他剂型,没有针对药物理化特性、临床应用需求等的考虑。2007年版《药品注册管理办法》规定,“对已上市药品改变剂型但不改变给药途径的注册申请,应当采用新技术以提高药品的质量和安全性,且与原剂型比较有明显的临床应用优势”。国内此类改剂型,多与现行法规要求不吻合。
复方调血脂药物非理性开发
近年来,国内他汀类产品也开始出现一些参照国外研发情况进行的复方制剂研发,但存在对复方制剂研发背景调研不充分,立题评估不准确的情况,如:某由他汀和贝特类药物组成的复方制剂,已获得印度上市许可,临床用于治疗原发性高胆固醇血症、混合性血脂异常、高甘油三酯血症。但,由于已知两类药物合用可能导致严重不良反应,且两单方各自的说明书中已有同时应用时应慎用或“不建议合用”的说明;同时,该复方产品的安全有效性缺乏直接充分的临床试验资料的支持,故该复方未获得在国内进行临床试验的批准。
品种申报不均衡
个别品种的申报过于集中,尤其体现在2007年以前的大量申报中。如辛伐他汀,尽管国内已有多家获准生产,但申报者仍甚多。
上述我国国产他汀药物上述研发申报和审评状况特点与我国国产品种整体研发状况基本一致。
外资:专利产品线进一步延伸
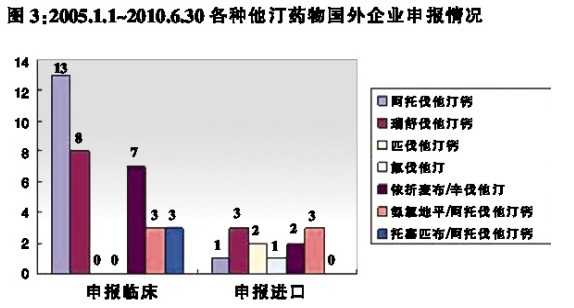
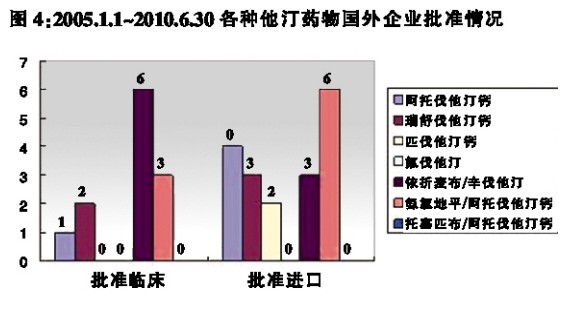
2005年1月1日~2010年6月30日期间,各种他汀类药物由国外企业申报及批准的具体情况见图3、图4。其中,进口申报包括进口原研企业和进口仿制企业的申报,原研企业的申请占绝大多数。
批准进口的6件氨氯地平/阿托伐他汀钙申请中,3件为增加新适应症的申请。
图3、图4数据显示,①2005年1月1日~2010年6月30日期间,国外企业他汀类药物申报临床和批准临床的总量分别为34件和12件;②2005年1月1日~2010年6月30日期间,国外企业他汀类药物申报生产和批准生产的总量分别为12件和18件;③申报和批准的品种数量明显少于国内企业,主要包括原研新他汀药、新适应症及新复方。
[申报现状及存在问题]
根据近年来进口申报和批准情况分析可知,国外企业在他汀类药物的研发中,一方面,不断有新的他汀家族产品稳步推出,如:瑞舒伐他汀钙和匹伐他汀钙的研发上市;另一方面,老一代成熟产品也从不同角度推陈出新,如:
新适应症研发
根据不断深入的他汀类药物基础研究数据及其上市后不断开展的大型临床试验研究结果,进一步开发新的适应症领域,以获得“老药新用”的目的;例如:阿托伐他汀钙片,在最早上市时均仅获准用于“原发性高胆固醇血症”患者,之后在多项大型临床试验数据支持的基础上获准增加了“用于冠心病患者或冠心病高危人群以预防心血管事件”的新适应症。这些上市后大规模临床数据与大量药物基础研究显示的他汀类药物的多种作用机制相吻合,可支持新适应症的批准。
新剂型开发
根据产品特性和临床需求开发适宜剂型。例如:烟酸的调脂作用明确而全面,既能有效降低血浆甘油三酯,升高高密度脂蛋白-胆固醇,也能降低总胆固醇和低密度脂蛋白-胆固醇,而且还具有独特的降低脂蛋白a的作用。但由于其皮肤潮红等不良反应限制了其临床应用,针对此,国外研发者开发了烟酸缓释制剂,克服了烟酸生物半衰期短的弱点,并通过降低峰值浓度,减少服药次数,而提高了药物的耐受性和安全性。由此,烟酸缓释制剂的问世使这类具有悠久历史的调脂药物焕发出了新的生命力。
此外,国外近年来也申报了一些新的复方制剂,如:将新型降脂药-肠道胆固醇吸收抑制剂依折麦布与已上市多年的辛伐他汀组成复方、以及将已上市降压药氨氯地平与已上市调脂药阿托伐他汀组成复方。这些复方制剂的研发多是在原研厂已有专利产品的基础上进行的开发,一定程度上保证了专利产品线的进一步延伸,但对于此类复方产品也应慎重审视其组方合理性。
注:批准进口的4件阿托伐他汀钙申请中,3件为增加新适应症的申请
来源:医药经济报
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx