FDA上半年批准20个新药
2005年FDA批准新药数量严重下滑之后,到2010年一直处于低谷。据统计,2005年FDA批准的新药数量为20个,比2004年少了14个。2006年批准数量为18个,2007年为17个,达历史最低,2008年为24个,2009年为25个,2010年21个。持续6年的低迷之后,在2011年制药行业新药研发终于有了复苏的迹象。截至2011年7月底,FDA批准了20个新药。这一令人鼓舞的转变,得益于制药公司改变了新药研发策略,从已知有良好治疗效果的me-too药物聚焦到了未知全新治疗领域药物的开发。也许正是这样的勇气,让了无生机的制药行业有了久逢甘露的喜悦。
上半年新药超去年同期
据美联社报道,FDA药品研究与评价部(CDER)主任Janet
Woodcock日前在FDA的新闻发布会上说:“我们看到的创新数不胜数,根本就记不过来。”根据FDA的报告,今年前两季度已经批准的“新分子实体”数量已和去年全年水平相当。与临床上已有的药品相比,这些药物在作用机制或治疗效果上都具有明显优势。
最近FDA
批准了首个可延长晚期黑素瘤(一种致死性皮肤癌)患者生存期的药物,以及50年来批准的首个治疗狼疮的药物。此外还批准了治疗效果明显优于现有治疗药物的2个丙肝药物。
Janent Woodcock
指出,药物研发当下正处在“转折点”。她补充解释道:“如果你是一位得了癌症或其它严重疾病的患者,看到这些新药获批备受鼓舞。”
现有新药的研发速度及批准数量已不能满足制药公司的需求。因为制药巨头们的畅销药物正在逐一失去专利保护,其中包括排名第一的辉瑞的降胆固醇药阿托伐他汀钙(立普妥)。该药将于今年11月失去专利保护。据预测,到2015年辉瑞将因仿制药竞争,损失累计达1000亿美元。
这些新药品种并不能扭转“专利悬崖”所带来的冲击,但能起到缓冲作用。根据Credit
Suisse分析师Catherine
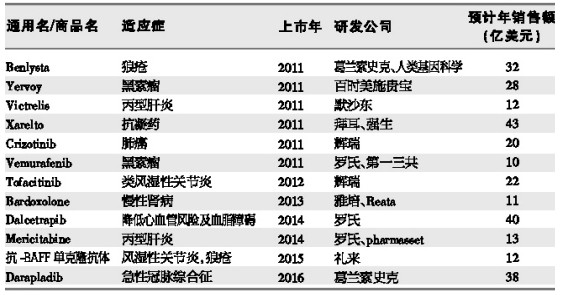
Arnold预计:未来3年,将有20多个年销售额有望达到甚至超过10亿美元的创新性新药获得FDA批准(见下表)。
市场注重成本意识
新药开发是一个不断充满变数的过程。而如今的市场是一个更加注重成本意识的市场。特别在有很多仿制药可供选择的条件下(从抗高血压类药物到降血脂类药物)。因此,美国医疗计划与外国政府的卫生系统要求,在同意为这些新药埋单之前,厂家需提供有关这些新药疗效比现有药物更优的证明。这就是制药公司对创新药高度关注的原因之一。对那些专利即将到期的质子泵抑制剂或抗抑郁症类药物做出一点点改进之后并可拥有一项新的专利,再利用专利而享有多年市场独占权的品牌药的时代已一去不复返。如果制药商能够为严重性疾病提供一种有效药物,即使制药商对这个药物定价很高,医保健康计划也愿意接纳这个药物。
当前批准的新药标志着制药工业早在数年前就已调整了研发的方向,尤其在一连串预警之后。其中对制药行业冲击最大的莫过于辉瑞研发的Torcetrapib惨败的事件。2006年有望成为立普妥替代品的心脏病药物Torcetrapib因临床试验失败而使辉瑞陷入低谷。Torcetrapib被认为是一种比较好的降胆固醇类药物,在公司董事会对该药有关临床试验监控并获知该产品可增加病人的死亡风险之前,辉瑞一直极力推出这一产品。Torcetrapib临床试验的失败意味着辉瑞所投入的16年时间及近8亿美元的研发成本成为泡影。
现代研发模式有利有弊
然而,即使是现代化药物研发模式下也存在弊端。制药公司建立了覆盖全方位药物研发的巨型实验室,并对整个研究体系进行密切监管,对项目的商业前景进行评估,要求研发人员进行定期信息更新等。然而对研发信息的保密与对接也是一个很难把握的问题。科学家必须对工作进行保密,要求在无别人觉察的情况下进行新药研发。正如赛诺菲首席执行官Christopher
Viehbacher说:如果公司想深入了解疾病的发病机理,则不能对研发人员进行信息密闭,因为信息对接在新药研发中会带来突破性效果。
此外,研发成本也是一个问题。根据Bernstein
Research公司的调研结果:2006年,制药公司对新药研发投资为458亿美元(或公司财政收入的17%)。如果从财政角度出发,大规模的生产方法并不能提高公司的产出率。就此,一些投资者开始质疑,与其支持制药公司对药物研发的全然投入,还不如支持那些从大学实验室里脱颖而出的有前途的小公司的研究成果,然后再与他们联合开发。
根据FDA的报告,今年前两季度已经批准的“新分子实体”数量已和去年全年水平相当。与临床上已有的药品相比,这些药物在作用机制或治疗效果上都具有明显优势。
FDA近几年内有望批准的重点品种
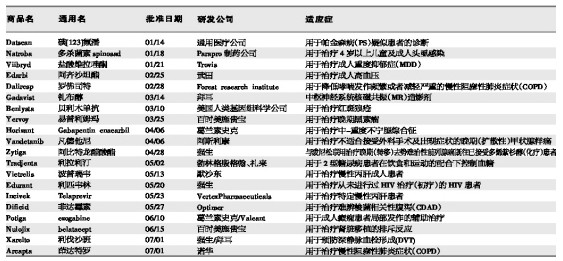
上半年FDA批准的20个新药
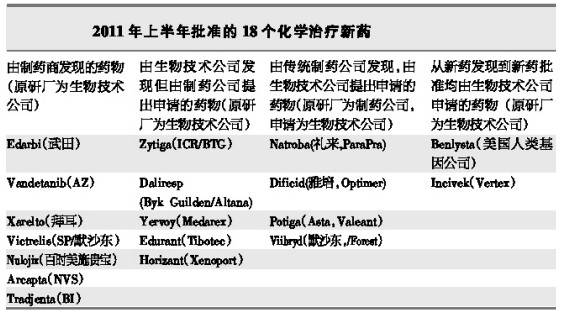
上半年FDA批准新药原研和申报信息
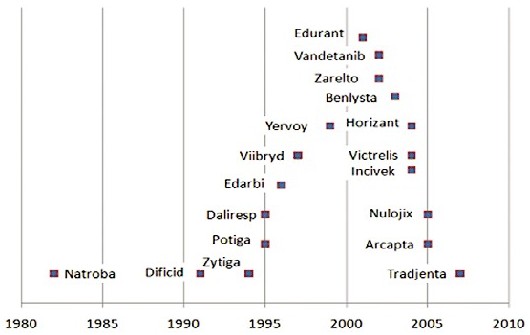
上半年FDA批准新药首次公开信息的年限
来源:医药经济报
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx