回顾与展望:新药2010与2011
根据FDA批准新药报告,2010年共有21个新药获得FDA批准(不包括新组分和新适应症),比2009年的25个和2004年的24个略低,高于2007年的18个。
加大安全考虑
新批准药物包括一些重要的生物制剂,如安进一年2次治疗绝经后妇女注射型的骨质疏松药物狄诺塞麦(Prolia),罗氏旗下的基因泰克静脉给药的治疗类风湿性关节药物炎药物Actemra。
勃林格殷格翰的达比加群酯胶囊(Pradaxa)于去年10月19日获得FDA批准,是一种心节律不规律患者卒中预防的血液稀释剂,成为大型制药公司中华法林替代药物领域的领跑者。
而阿斯利康的抗凝血药物Brilinta在2010年最后一个月遭遇挫折,FDA要求提供更详细的研究信息,Brilinta的推迟使阿斯利康的股票下跌5%。
10月,首个多发性硬化症口服药物诺华的Gilenya获FDA批准,而在年初,FDA还批准Acorda公司的改善多发性硬化症的药物Ampyra。
8月,FDA批准一种新的紧急避孕药ella,该避孕药可以在无保护性交之后5日内服用以避免意外怀孕,该药由法国HRA Pharma制造,在美国由Watson制药代销。
4月,曾被拒批过的Dendreon公司的前列腺癌药物Provenge获批,该药可调动患者自身的免疫系统对抗癌症,成为一种新型的抗癌药。
不过,2010年还有一些被看好的药物被FDA拒绝,也有一些被要求退市。
FDA推迟了安进和礼来的糖尿病特效药Byetta的长效新版本Brilinta,要求提供更多临床数据以消除心血管安全方面的担忧。
10月,FDA再次拒绝了Arena制药公司和Vivus公司的两个减肥药。
由于担心增加心脏病发作风险,9月,FDA宣布极大程度限制葛兰素史克文迪雅的临床使用范围。
10月,雅培的减肥药西布曲明因心脏病发作和卒中不良反应增加而被要求退市。而止痛药Darvon和Darvocet也因增加心脏节律异常风险退市。
也是在10月份,由于给患者带来的益处并不能超过其潜在的用药风险,FDA撤销了罗氏的安维汀在晚期乳腺癌的应用并要求罗氏修改处方药标签信息。
最近,FDA称需要更多时间对MannKind吸入式胰岛素Afrezza进行评价,还需要在3月对人类基因组科学公司和葛兰素史克系统性红斑狼疮新药Benlysta再次裁决。
待批新药
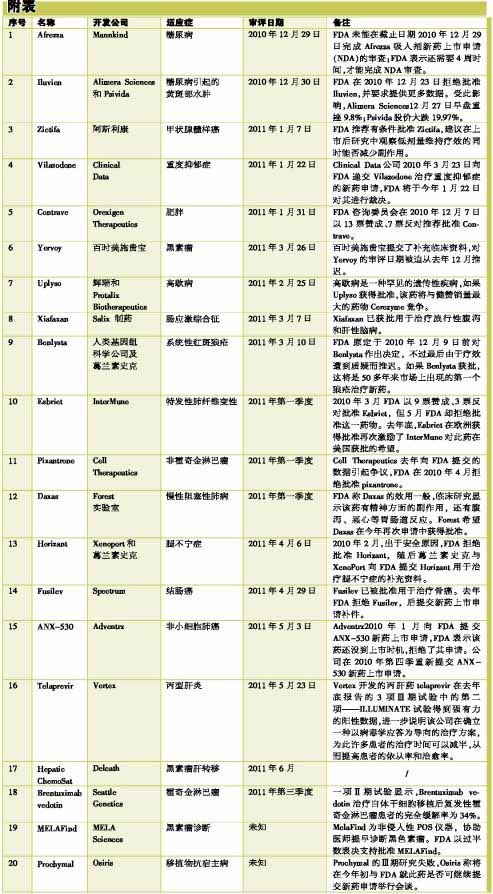
在2011年,将有20多个新药(或器械)等待FDA批准(见附表)。
链接>>>
EMA:2011新药数量与2010持平
■李勇
2010年,欧洲药品管理局(EMA)批准的新药仅为14个,创历年来新低。不过EMA预计2011年将收到97个药物上市申请,与2010年的95个基本持平。
EMA管理委员会预计2011年药物上市申请包括40例人用新药(2010年为38例),12例罕见病新药(2010年为14例),42例仿制药(2010年为41例)。
2011年EMA批准的预算达2.089亿欧元,比2010年增加0.23%,包括费用收入1.61亿欧元(2010年为1.528亿欧元)和欧盟捐赠的3350万欧元(2010年为3910万欧元)。欧盟提供的罕见病药物特别基金有所下降,从去年的820万欧元降至2011年490万欧元。
EMA预计在今年不会增加工作人员,稳定在2010年567名“暂时代理人”的水平。
EMA管理委员会放弃了到2015年新的战略,并表示:“首先稳固2005~2010的路线图,新的战略是重点关注EMA核心业务,还有未来加强EMA对公众健康需求作用的3个优先领域,促进药物使用的安全性。”
来源:医药经济报
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx