4月23日,复旦大学药学院邵黎明教授团队在Nature Reviews Drug Discovery(IF=122.7)杂志发表了一篇报道,深入分析了我国药品加快上市注册程序(ADMRP)对新药审批流程的深远影响。

2015年以来,我国政府陆续颁布了一系列旨在加速药物开发和审批途径的政策,包括2015年的《关于改革药品医疗器械审评审批制度的意见》、2020年的《药品注册管理办法》等。
其中,《药品注册管理办法》中引入了药品加快上市注册程序(Accelerated Drug Marketing Registration Procedure,ADMRP),旨在大幅缩短药物从开发到上市的时间。
如表1所示,ADMRP途径包括四种特殊审批途径:
突破性治疗药物(Breakthrough Therapy Drug,BTD)
附条件批准(Conditional Approval,CA)
优先审评审批(Priority Review and Approval,PRA)
特别审批(Special Approval,SA)
表1. 《药品注册管理办法》中四种ADMRP途径的定义及适用范围

通过对NMPA年度药品审评报告中获批新药数量、审批时间和治疗领域等数据的深入分析,研究团队发现了以下结果:
▌获批新药数量
如图1a所示,2016-2024年期间,NMPA共批准了1100种新药,包括692种(63%)化学药、368种(33%)生物制品和40种中药(4%)。总体而言,在此期间获批的新药数量呈逐渐上升趋势,除了2022年出现下降(图1b),这可能是由于COVID-19大流行的影响。
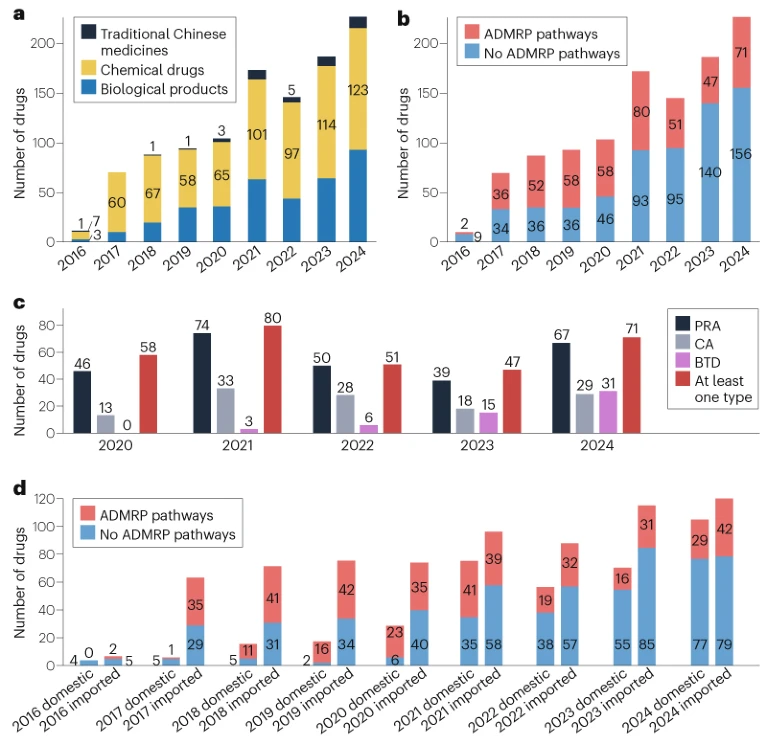
图1. 2016-2024年NMPA批准的新药
在这1100种新药中,近40%(455种)通过ADMRP审评途径获得批准。如图1c所示,2020-2024年期间,三种特定的ADMRP途径被用于药物审批:PRA途径占批准的大部分,有276种产品;其次是CA途径,有121种产品;值得注意的是,BTD批准的新药数量每年都在增加,从2020年的0种增加到2024年的31种。
如图1d所示,尽管2016-2024年期间进口药的批准数量一直高于国产药,但国产新药进展显著,2024年批准数量达106种。在使用ADMRP途径批准的455种药物中,2021年批准的国产药物数量最多(41种)。
▌审批时间2015年药品审评审批制度改革后,2016-2024年期间,使用ADMRP途径的药物的平均审批时间为422天,比非ADMRP药物的平均审批时间快147天。ADMRP途径对国产药物和进口药物的平均审评时间分别缩短了167天和110天。
研究人员还按药物类型统计了新批准药物的审查时间。结果发现,使用ADMRP途径批准的化学药物的平均审查时间为438天,比非ADMRP批准快192天。与非ADMRP批准相比,生物制品的平均审查时间也缩短了79天。
2016-2024年期间,ADMRP途径显著缩短了新药的审批时间,反映了药物审评和审批过程整体效率的显著提高(图2a)。2020年《药品注册管理办法》中概述的“优化审评审批流程”的举措进一步提升了新药注册时间的可预测性。
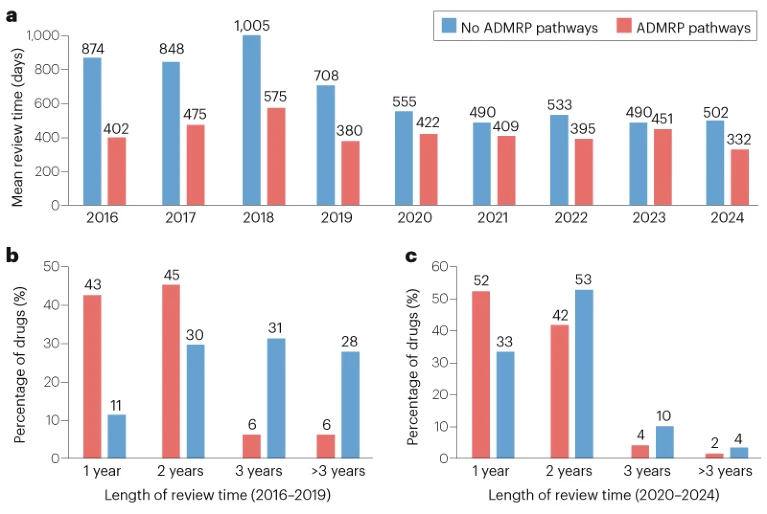
图2. 2016-2024年NMPA批准新药的审评时间
2016-2019年期间,通过ADMRP途径批准的大多数新药(88%)在2年内得到处理,而超过一半(59%)的非ADMRP批准需要3年或更长时间(图2b)。2020-2024年期间,两组的平均审核时间进一步缩短,94%的ADMRP途径获批新药和86%的非ADMRP途径获批新药均在不到2年的时间内完成审批,特别是CA和BTD途径的审评时间进一步缩短。
▌治疗领域
2016-2024年NMPA批准的1100种新药中,抗癌药最多,有382种(35%),其次是内分泌代谢类药物128种(12%)、抗感染类药物96种(9%)、神经类药物94种(9%)和呼吸类药物50种(5%)。
如图3a所示,使用ADMRP途径的抗癌药物批准数量最多,有219种(48%),这反映了行业的研发重点与政府对创新新癌症治疗的临床需求的认可之间的高度一致性。此外,在2016-2024年期间,44种(10%)抗感染药物和39种(9%)神经药物通过ADMRP途径获得批准。相比之下,非ADMRP批准包括163种(25%)抗肿瘤药物,96种(15%)内分泌、营养或代谢药物,以及55种(9%)神经药物(图3b)。
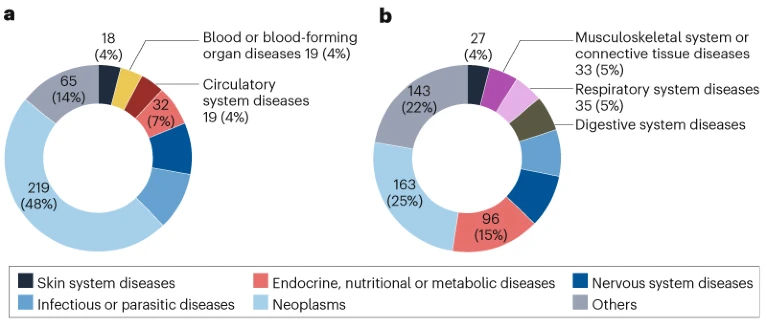
图3. 2016-2024年NMPA批准新药的治疗领域分布
▌结论ADMRP途径大大缩短了新药的平均审查时间,提升了审批效率。我国药品监管体系的持续改革,不仅改善了新疗法的可及性,让患者更快获得新的治疗选择,也促进了国产和进口药的市场准入,推动了医药产业的健康发展。
参考资料:
Yingge Gu et al. The impact of accelerated drug marketing registration procedures on the review and approval of new drugs in China. Nature Reviews Drug Discovery(2025)
https://www.nature.com/articles/d41573-025-00070-6
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx