诺华“错过”ADC风口,是战略放弃还是另寻新机?
发布者:国际药物制剂网
发表时间:2024/1/23 点击:
564
次
2023年是并购和BD交易的大年,这一趋势在2024年也有所延续。
据有关数据统计,2023年医药领域发生的并购事件大约有110件,披露的并购总金额超过1500亿美元。在这些交易的背后,是跨国药企对下一个重磅炸弹的渴望。
从交易标的涉及领域来看,ADC疗法尤为惹人注目,交易总价值不断走高,辉瑞、艾伯维、阿斯利康、GSK、礼来等跨国药企不断掀起巨额交易,从包括中国市场在内的全球医药赛道“广撒网”。
然而,在这一轮ADC项目“军备竞赛”过程中,诺华并未在过去的一年“随大流”购买任何ADC相关资产,无论是主动还是被动“错过”,诺华都选择了保持冷静。
诺华为何在这一波浪潮中如此低调?还是曾经在ADC领域遭遇的挫折,让诺华对研发布局有着新的思考?
“高壁垒管线”能否胜出?
前不久,诺华首席执行官 Vas Narasimhan 公开表示,诺华在ADC赛道耕耘已久,但并未取得积极进展。因此,希望可以发挥自身所长,加大对放射性配体药物的投资。
Narasimhan 认为,与某些 ADC 相比,放射疗法可能具有安全优势。“我们相信,当你找到正确的靶标时,放射性配体疗法的治疗指数将为你提供相当宽的窗口来获得治疗效果,而不会出现一些安全问题。”
众所周知,ADC 最令人担忧的副作用之一是间质性肺病 (ILD),这是一种以肺部疤痕为特征的潜在危及生命的疾病。阿斯利康和第一三共的 TROP2 ADC Dato-DXd 的 3 期非小细胞肺癌临床试验最近报告了7 例 ILD 死亡,经确定与药物相关。在其中四例中,疾病进展被认为是死亡的主要原因。
“如果你可以在放射配体治疗中避免这种情况,但仍然获得那么高的疗效——而且考虑到我们现在的供应完全不受限制,我们认为诺华所做的投资是一个更好的地方。资本可以集中在 ADC 上,而不是过度集中在ADC。” Narasimhan如是说。
放射性配体疗法(RLT)是诺华研发投入的全球五大关键技术平台之一,诺华在开发含放射性成分精准靶向药物及疗法领域积累了高度专业化的研发、生产与临床应用,以及跨学科、跨行业合作的经验。
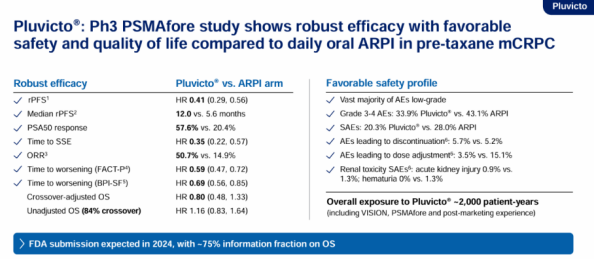
Pluvicto和Lutathera是诺华在放射性配体药物赛道的核心产品,分别靶向前列腺特异性膜抗原(PSMA)和生长抑素受体(SSTR)。其中,Pluvicto于2022年3月获得FDA批准,用于PSMA阳性转移性去势抵抗性前列腺癌三线治疗,成为全球首款靶向PSMA的放射性配体疗法。据悉,2023年上半年,在供应极度紧张的情况下,Pluvicto销售总额达到4.5亿美元,据诺华预计,Pluvicto的年销售额峰值有望超过30亿美元。诺华对Pluvicto非常期待的原因,除了其创新疗法之外,更重要的一点在于,mCRPC适应症领域被颠覆的难度较大。mCRPC领域之所以治疗手段有限,核心在于研发不易。由于具有较低的肿瘤突变负荷+冷肿瘤属性等诸多原因导致,免疫疗法针对mCRPC就有心无力。哪怕是PD-1抑制剂中的王者K药,面对前列腺癌也是四战四败。但凡做出一些有利数据,就一定能够抢占市场。
此外,在产能方面,美国时间1月5日,诺华表示其位于印第安纳波利斯的放射性药物新生产基地已获得FDA的批准,可生产商业化用途的Pluvicto。据悉,印第安纳波利斯生产基地是诺华在美国获得FDA批准的第二个放射性配体疗法(RLT)生产基地,该基地占地70000平方英尺,可使RLT的产能在2024年及以后增至每年25万剂,是全球最大、最先进的RLT生产基地。
Lutathera也是一款放射性配体药物,能结合肿瘤细胞表面的生长抑素受体,并进入细胞,通过放射性对肿瘤细胞造成损伤。Lutathera在2018年获得美国FDA批准治疗经治SSTR阳性的GEP-NETs患者,是首款FDA批准的放射性配体疗法。2023年9月,诺华宣布Lutathera在3期临床试验NETTER-2中达到主要终点。Lutathera联合长效奥曲肽(octreotide)一线治疗与单用高剂量长效奥曲肽相比,可显著改善新确诊的生长抑素受体(SSTR)阳性、2级和3级晚期胃肠胰神经内分泌肿瘤(GEP-NETs)患者的无进展生存期(PFS)。值得关注的是,这也是首次放射性配体疗法在一线治疗中表现出具有临床意义的获益。
有市场观点指出,从整体的氛围可以感受到,诺华目前还没有进入ADC的考虑,尽管ADC和放射性配体平台存在一定的竞争关系,诺华更加关注的放射性药物平台,而这个领域同样带有一定的“护城河”。
在ADC领域抽身原因几何?
事实上,在ADC领域的赛道上,诺华也是一个参与者。
十余年中,诺华也曾尝试与行业巨头ImmunoGen合作。ImmunoGen是国际上最早研发ADC药物的企业之一,曾与Seagen、Genentech并称为ADC领域的“三巨头”。ImmunoGen掌握核心技术专利,曾是安进、拜耳、罗氏、礼来、诺华、赛诺菲、武田ADC产品背后的技术支持者。
早在2013年,诺华与ImmunoGen公司就达成技术收购协议,拟接手后者靶向抗体与药物偶联技术(ADC),该技术主要用于癌症的治疗。ImmunoGen的竞争力则来自其在靶向杀伤肿瘤的抗体与高效抗肿瘤化药偶联(ADC)的技术。
不过,诺华在ADC领域的试水似乎并不顺利。诺华与ImmunoGen合作过的三款靶向CDH3、CDH6和tc-ki的ADC药物,未能取得预期的进展,自研的两款管线也逐渐淡出布局管线。
具体来看,诺华曾布局一种P-钙粘蛋白靶向ADC药物PCA062,该产品于 2015 年进入临床Ⅰ期。2022 年末,在Ⅱ期临床试验中,所有患者至少出现1级AE反应,32 名患者的AE等级甚至≥3级。其中,37 名患者出现疑似与研究药物 PCA062 相关的AE。最终,诺华也放弃了这条管线。
在ADC布局上,诺华的管线目前进展最快的才到临床Ⅰ期。对比之下,同样是偶联药物,诺华在RDC领域取得了绝对优势,于是在ADC和RDC之间,诺华并没有选择两个都要,而是做出选择布局核药。
在产业创新生态加速迭代,技术方向趋向多元的当下,如何保持专注、持续增长,无疑是诸多企业思考的关键命题。
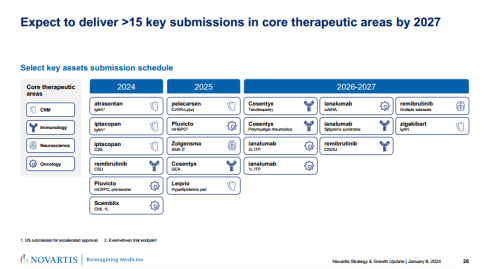
在此前的JPM大会上,Vas Narasimhan也宣布了诺华未来的战略重点。将专注于四大核心治疗领域,包括心血管-肾脏-代谢、免疫、神经科学和肿瘤学;在研发方面,诺华则会重点关注高影响力资产,如Kisqali、Pluvicto等,并计划在2024—2027年提交超过15个关键申请;在新技术平台策略上,诺华将专注于“2+3技术平台”,涵盖化学、生物治疗、xRNA、放射性配体、基因和细胞疗法。

此外,Vas Narasimhan还分享了到2027年的计划,包括在四大核心治疗领域提交的超过15项关键申请,以及两款CGT疗法,治疗SMA的Zolgensma和长效siRNA降血脂Leqvio将在2025年迎来新的进展。总体而言,诺华在JPM大会上展示了强大的研发和业务战略,把握RDC发展优势的同时,也尤其注重新兴技术疗法的发展,力争通过“All in”的方式在核心治疗领域建立压倒性优势。