2023年药品申报依旧呈上升趋势,2023年国家药品监督管理局药品审评中心(以下简称CDE)共受理11455个品种,包含受理号16812个(数据统计截至2023年12月31日,包含受理号和品种(药品+企业)两个统计维度,此统计不包含新冠药物受理号,下同),以下为详细的2023年药品注册审评情况分析。
01
2023年药品申请受理与审评情况
1、2023年申报整体情况
1.1全年受理情况
2023年CDE受理注册申请受理号16812个(11455个品种),同比增长37.32%;其中,中药申请受理号2761个(2569个品种),同比增长77.90%;化药申请受理号11825个(7645个品种),同比增长34.33%,占全年受理量的70.34%;生物制品受理号2214个(1320个品种),同比增长17.58%;2019-2023年注册申请受理情况详见图1。
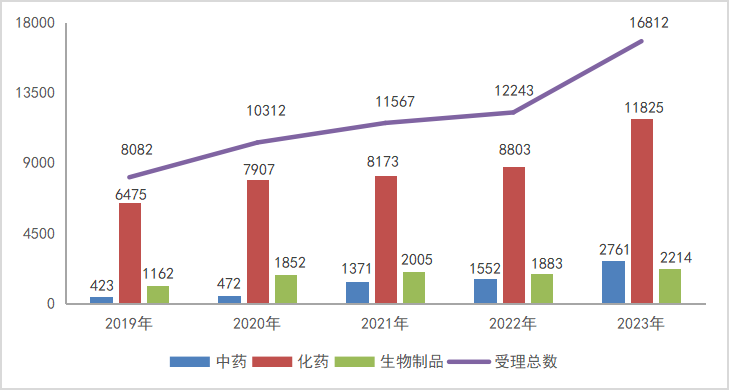
图1 2019-2023年注册申请受理情况
1.2全年各注册申请审评任务类型申报情况
2023年CDE受理申请以注册申请审评任务类型统计,受理新药临床试验申请(以下简称IND)1629个品种(受理号2942个),同比增加29.08%;新药上市许可申请(以下简称NDA)299个品种(受理号465个),同比增长39.07%;同名同方药、仿制药、生物类似药上市许可申请(以下简称ANDA)2998个品种(受理号3863个),同比增长72.20%;仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称一致性评价申请)681个品种(受理号1006个);目前整体来说每年NDA申报量占IND申报量的百分比大概在20%左右。2019-2023年各申请类别注册申请受理品种情况详见图2。
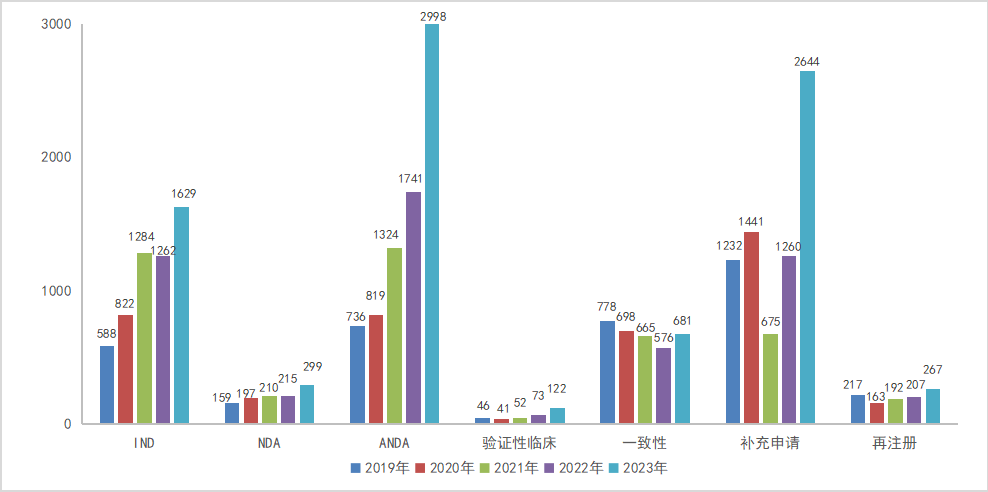
图2 2019-2023年各申请类别注册申请受理品种情况
1.3创新药注册申请受理情况
2023年1类创新药申请1310个品种(受理号2376个),同比增加33.81%。以药品类型统计,创新中药申请60个品种(受理号61个),同比增长33.33%;创新化学药626个品种(受理号1424个),同比增长35.50%;创新生物制品624个品种(受理号891个),同比增长32.20%。
以注册申请审评任务分类统计,IND申请1232个品种(受理号2246个),同比增长34.65%;NDA申请86个品种(受理号129个),同比增长115.00%。
2023年创新中药、创新化学药、创新生物制品注册申请受理情况详见表1;2019-2023年创新药IND受理品种详见图3;2019-2023年创新药NDA受理品种详见图4。
表1 2023年创新中药、创新化学药、创新生物制品注册申请受理情况
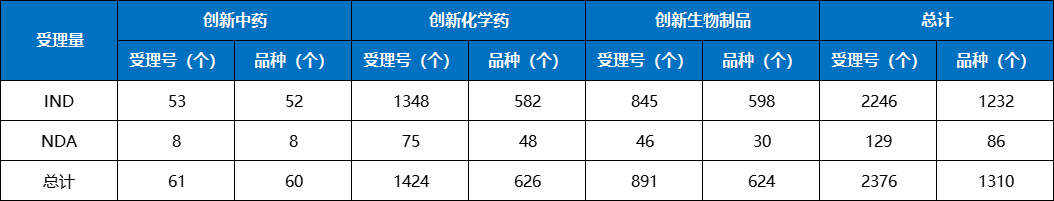
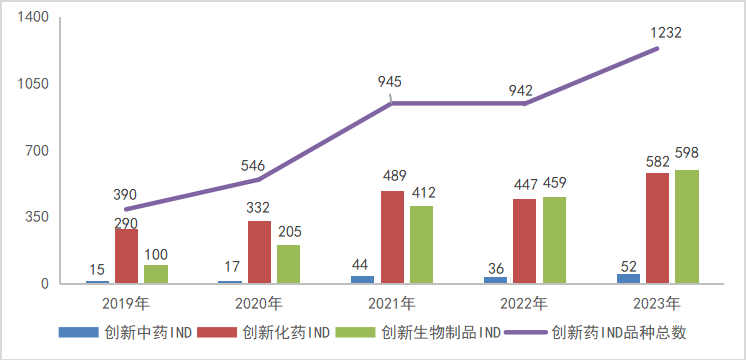
图3 2019-2023年1类创新药IND申请受理品种情况
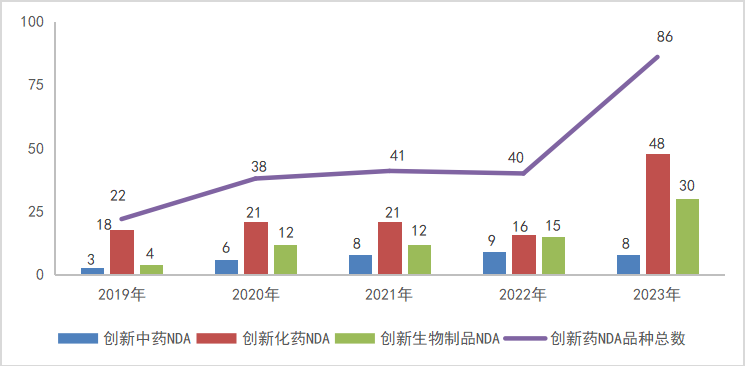
图4 2019-2023年1类创新药NDA申请受理品种情况
1.4改良型新药注册申请受理情况
2023年2类改良型新药申请394个品种(受理号701个),同比增加38.73%。以药品类型统计,创新中药申请23个品种(受理号23个),同比增长64.29%;创新化学药272个品种(受理号482个),同比增长35.32%;创新生物制品99个品种(受理号196个),同比增长43.48%。
以注册申请审评任务分类统计,IND申请331个品种(受理号586个),同比增长35.10%;NDA申请70个品种(受理号115个),同比增长59.09%。
2023年改良型中药、改良型化学药、改良型生物制品注册申请受理情况详见表2;2019-2023年改良型新药IND受理品种详见图5;2019-2023年改良型药NDA受理品种详见图6。
表2 2023年改良型中药、化学药、生物制品注册申请受理情况
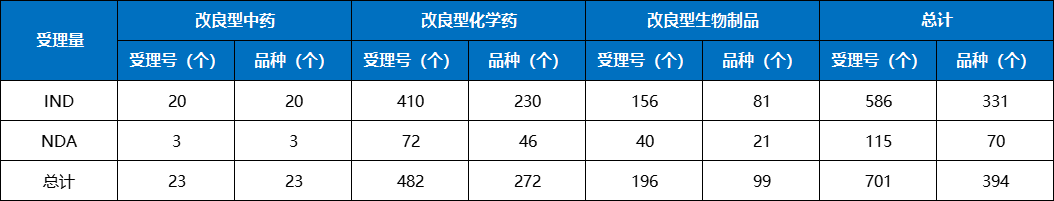
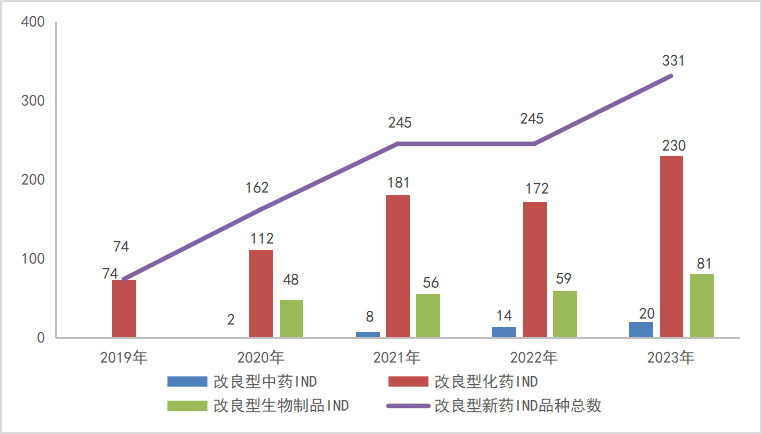
图5 2019-2023年2类改良型新药IND申请受理品种情况
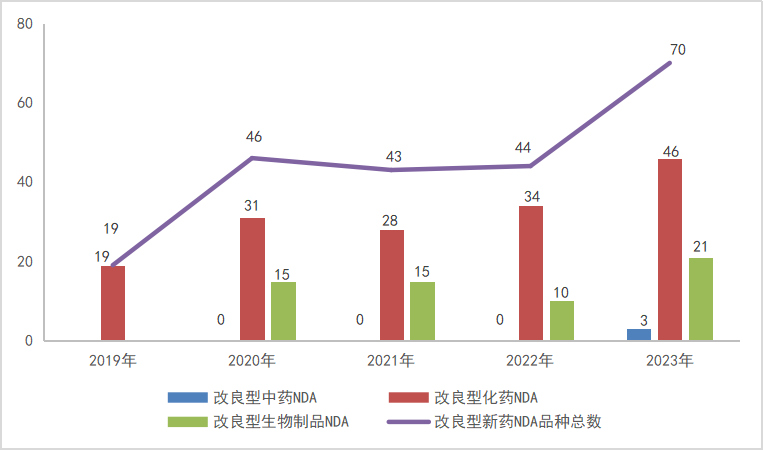
图6 2019-2023年2类改良型新药NDA申请受理品种情况
1.5申报地区情况
在国内各省市的药品申报方面(根据企业所在地统计),2023全年申报江苏以2304个受理号遥遥领先,其次上海以1697个受理号位于第二,随后依次为山东、浙江、广东;2023年国内各省市申报情况见图7。
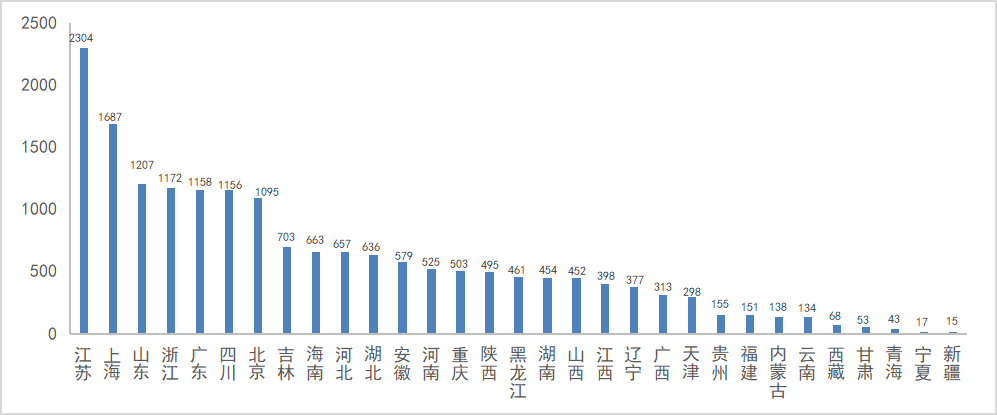
图7 2023年国内各省市申报情况
2、2023年完成审评整体情况
2.1全年完成审评情况
根据药智注册与受理数据库最新统计,2023年(注:状态开始时间(药智)从2023年1月1日至2023年12月31日)完成审评受理号14473个(9705个品种);以药品类型统计,中药完成审评2358个品种(受理号2522个);2023年全年化药完成审评6159个品种(受理号9868个);生物制品完成审评1176个品种(受理号2066个);2019-2023年各药品类型注册申请完成审评品种情况见图8。
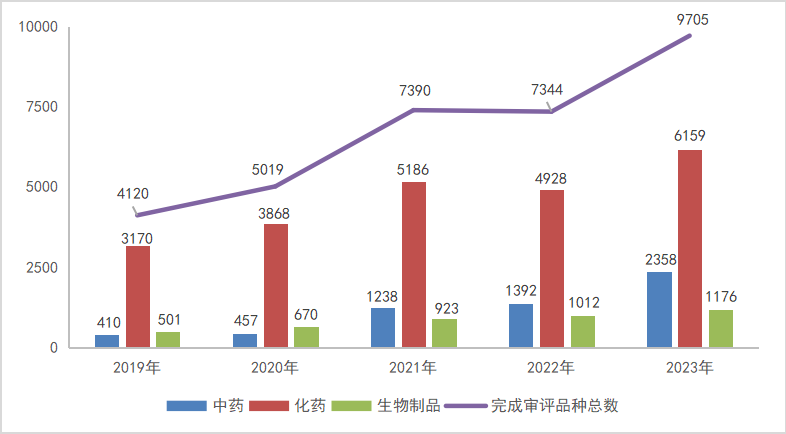
图8 2019-2023年各药品类型注册申请完成审评品种情况
药智收录到结论的数量为14045个受理号,对有结论的受理号进行分析统计,其中中药受理号2509个(2347个品种),化药受理号9572个(5993个品种),生物制品受理号1949个(1114个品种)。2023年注册申请审评完结结论详情统计见图9。
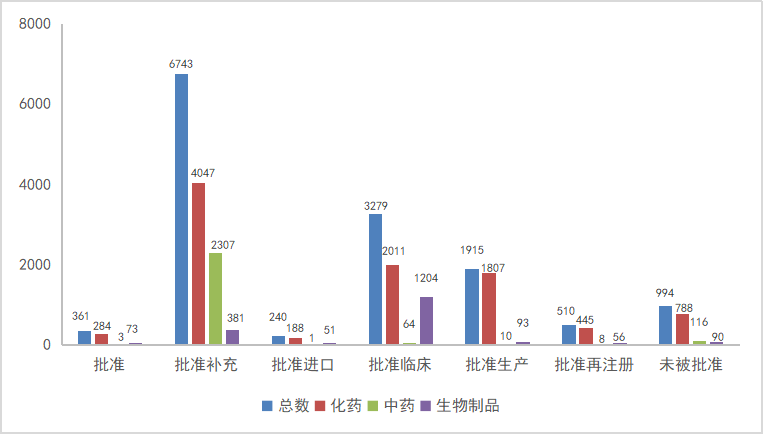
图9 2023年注册申请审评完结结论详情统计
2.2全年各注册申请类别完成审评情况
以注册申请类别统计,2023年CDE审评完成审评的受理号中,IND共1514个品种(受理号2673个),占总数的15.60%,NDA共651个品种(受理号419个),占总数的2.73%,ANDA共1726个品种(受理号2296个),占总数的17.78%,一致性评价共689个品种(受理号1004个);2019-2023年各审评任务类别审评完成品种情况详见图10。
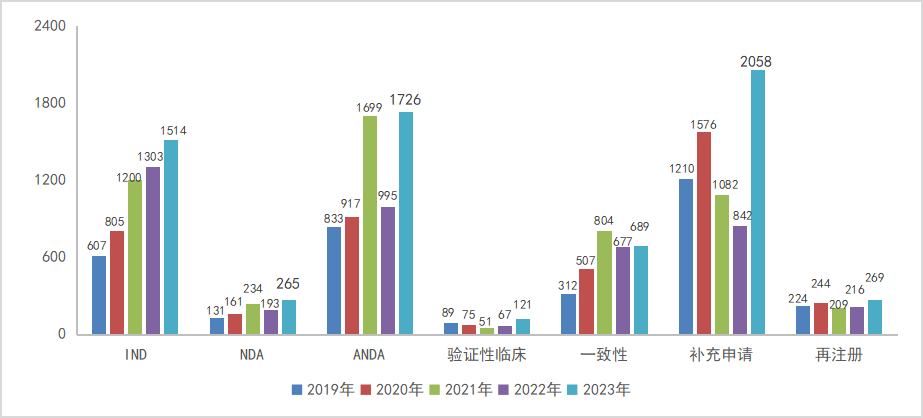
图10 2019-2023年各审评任务类别审评完成品种情况
2.3 2023年创新药、改良型新药完成审评情况
2023年1类创新药完成审评1202个品种(受理号2133个),同比增长21.29%。以注册申请审评任务分类统计,IND申请1149个品种(受理号2053个),同比增长19.07%;NDA申请53个品种(受理号79个),同比增长89.29%。2023年1类创新药获批上市共38个品种(54个受理号),适应症包含抗肿瘤领域、消化道及代谢、心血管系统等。
2023年1类创新中药、创新化学药、创新生物制品注册申请完成审评情况详见表3;2023年改良型中药、化学药、生物制品注册申请完成审评情况详见表4;2023年获批1类创新药ATC分布情况详见图11。
表3 2023年创新中药、化学药、生物制品注册申请完成审评情况
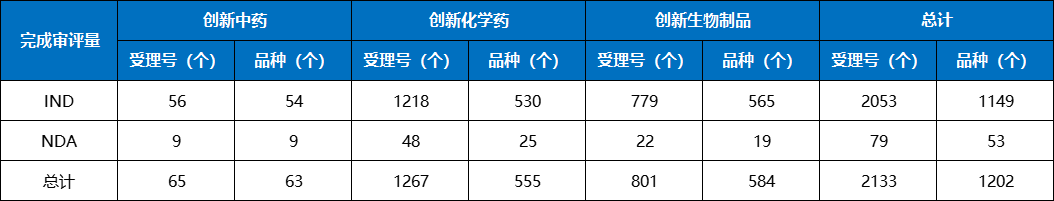
表4 2023年改良型中药、化学药、生物制品注册申请完成审评情况
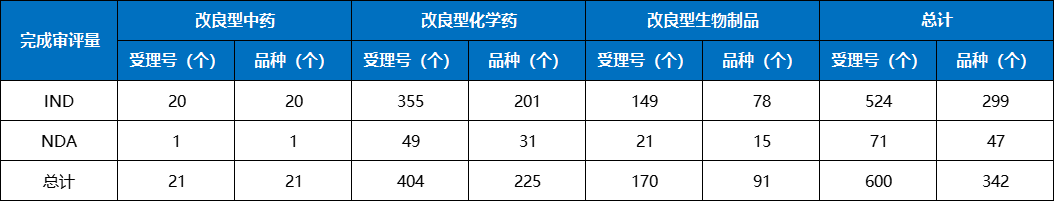
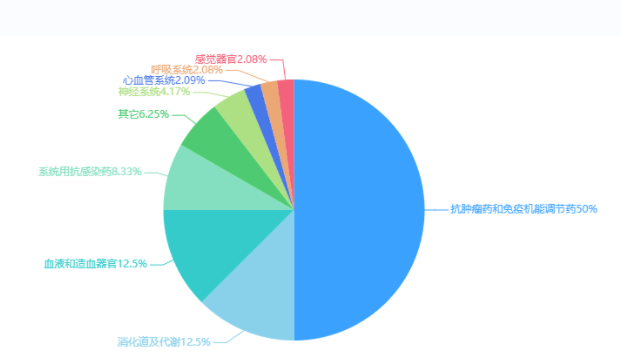
图11 2023年获批1类创新药ATC分布情况
02
2023年中药申报与审评情况
1、2023年中药申报情况
2023年CDE共受理中药注册申请2569个品种(受理号2761个),以注册申请类别统计,IND申请72个品种(受理号73个),同比增长35.85%,其中1类创新药IND申请36个品种(受理号38个),2类改良型型新药IND申请14个品种(受理号14个);NDA申请受理号24个品种(受理号24个),同比增长118.18%,其中1类创新药NDA申请9个品种(10个),2类改良型新药未有受理,3类经典名方申请2个品种(受理号3个)。以注册分类统计,2019-2023年中药各审评任务类别申请受理品种情况详见图12。
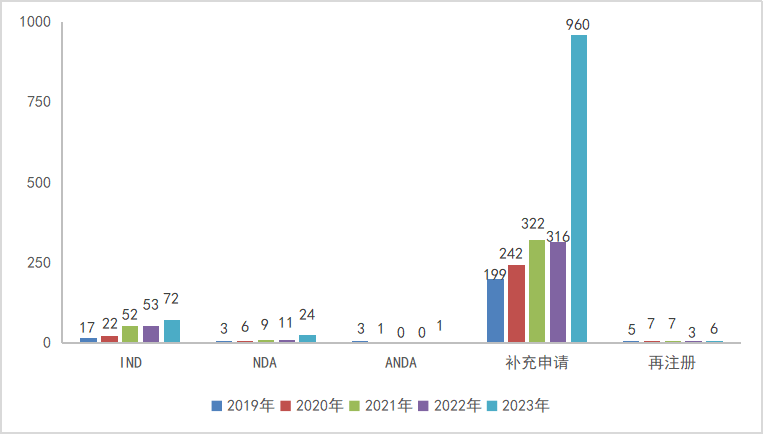
图12 2019-2023年中药各审评任务类别申请受理品种情况
2、2023年中药完成审评情况
在2023年CDE审评完结中药注册申请2358品种(受理号2522个,包含无需技术审评的受理号);以审评任务类别统计,IND申请75个品种(受理号77个);NDA申请18个品种(受理号18个);ANDA申请1个品种(受理号1个)。
2023年中药1类创新药共计4个品种获批上市,为参郁宁神片、小儿紫贝宣肺糖浆、通络明目胶囊、枳实总黄酮片;2类改良型创新药共计1个品种获批上市,为小儿豉翘清热糖浆;3类经典名方共计3个品种获批上市,为枇杷清肺颗粒、济川煎颗粒以及一贯煎颗粒。2023年批准1类创新药、2类改良型新药以及3类经典名方获批上市品种详情见表5。
表5 2023年批准1类创新药、2类改良型新药以及3类经典名方获批上市品种
03
2023年化药申报与审评情况
1、2023年化药申报情况
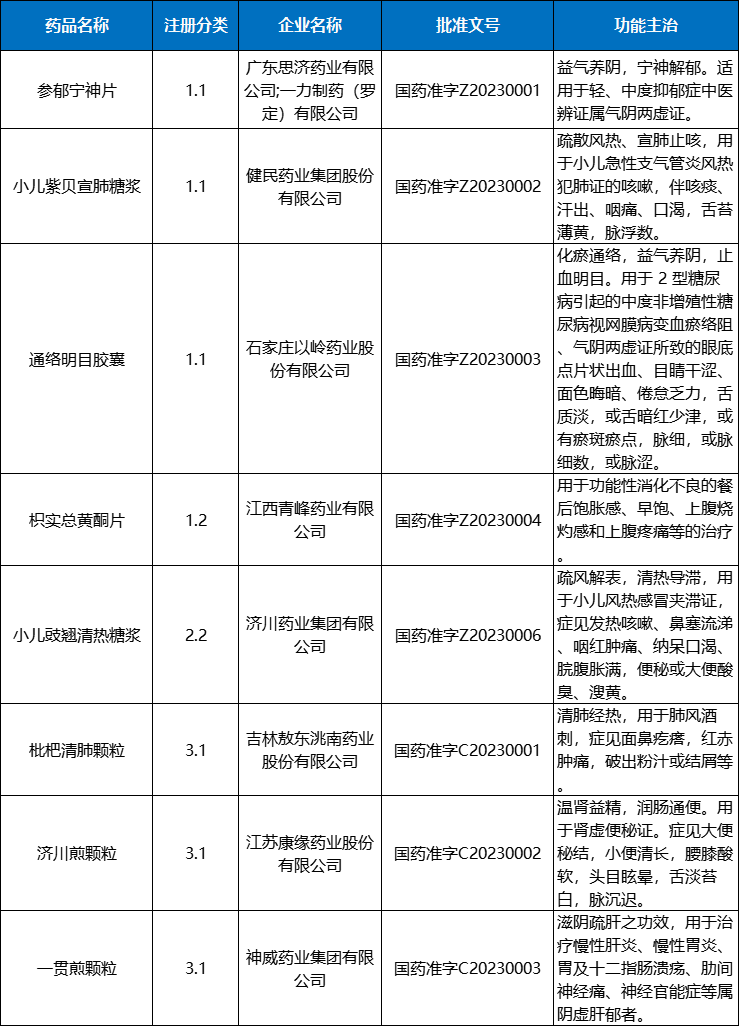
2023年CDE共受理化学药注册申请7645个品种(受理号11825个),以审评任务类别统计,IND申请813个品种(受理号1759个),同比增长27.63%;NDA申请159个品种(受理号246个),同比增长43.24%;ANDA申请2997个品种(受理号3862个),同比增长72.14%;一致性评价申请681个品种(受理号1006个)。以注册分类统计,2019-2023年中药各审评任务类别申请受理品种情况详见图13。
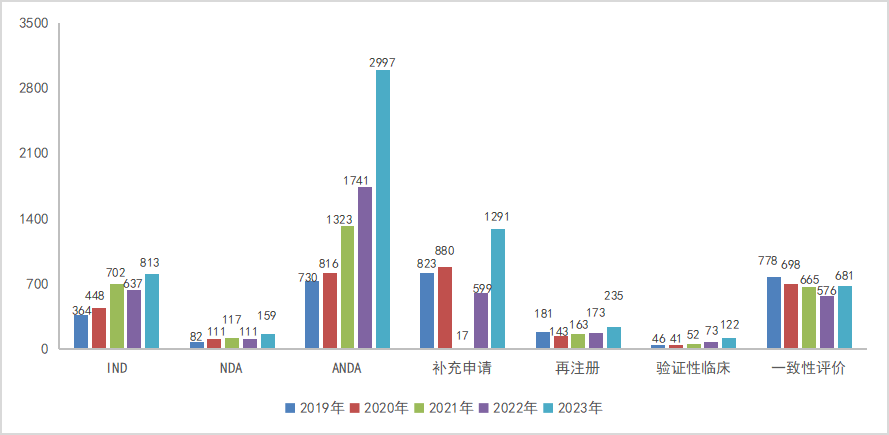
图13 2019-2023年化学药各审评任务类别申请受理品种情况
2023年受理化学药1类创新药受理626个品种(受理号1424个),其中IND申请582个品种(受理号1348个),NDA申请48个品种(受理号75个);化学药2类改良型新药受理个272品种(受理号482个),其中IND申请230个品种(受理号410个),NDA申请个46品种(受理号72个);5.1类化学药受理82个品种(受理号130个)。2019-2023年创新药、改良型新药、5.1类化学药品NDA品种受理情况详见图14。
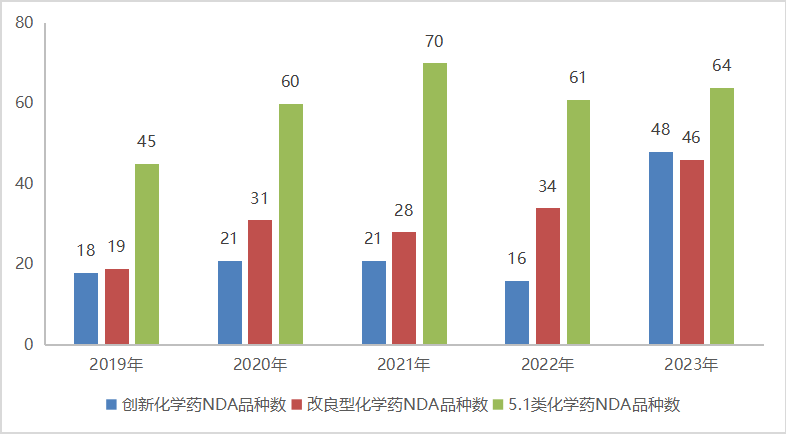
图14 2019-2023年创新药、改良型新药、5.1类化学药品NDA品种受理情况
2、2023年化药审评完结情况
2.1化药完成审评总体情况
2023年CDE共完成审评的化学药共6159个品种(受理号9868个,包含无需技术审评的受理号);以审评任务类别统计,IND申请733个品种(受理号1575个);ANDA申请1725个品种(受理号2295个),同比减少38.4%;NDA申请137个品种(受理号239个);一致性评价申请689个品种(受理号1004个);2023年化学药各审评任务类别完成审评情况详见图15。
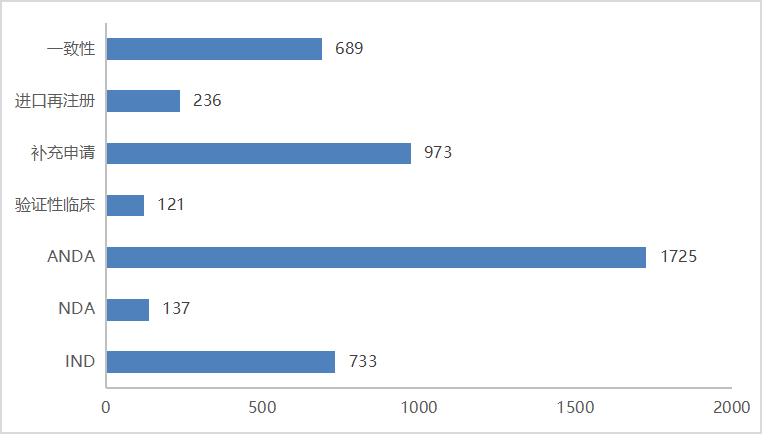
图15 2023年化学药各审评任务类别完成审评情况
2023年化药1类创新药获批上市有16个品种,涉及抗肿瘤领域、心血管系统等领域;2类改良型新药获批上市共计23个品种,2023年批准化药1类创新药以及2类改良型新药获批详情详情见表6、表7。
表6 2023年批准化药1类创新药

表7 2023年批准化药2类改良型新药
04
2023年生物制品申报与审评情况
1、2023年生物制品申报情况
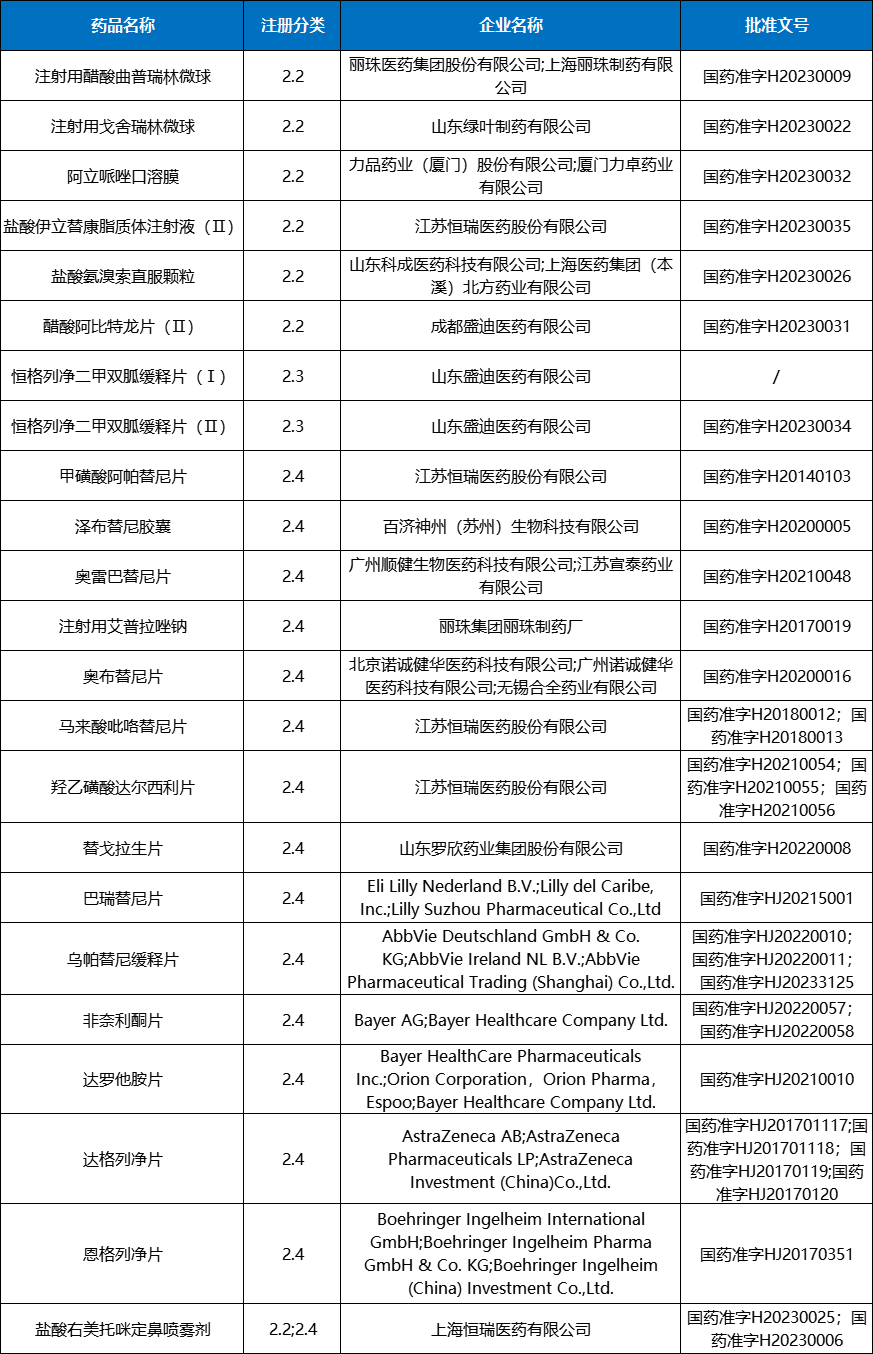
2023年CDE受理生物制品注册申请1230个品种(受理号2214个),同比增长21.18%。其中受理生物制品IND申请744个品种(受理号1110个),同比增长30.07%;受理生物制品NDA申请116个品种(受理号195个),同比增长24.73%;2019-2023年生物制品注册申请受理情况详见图16。
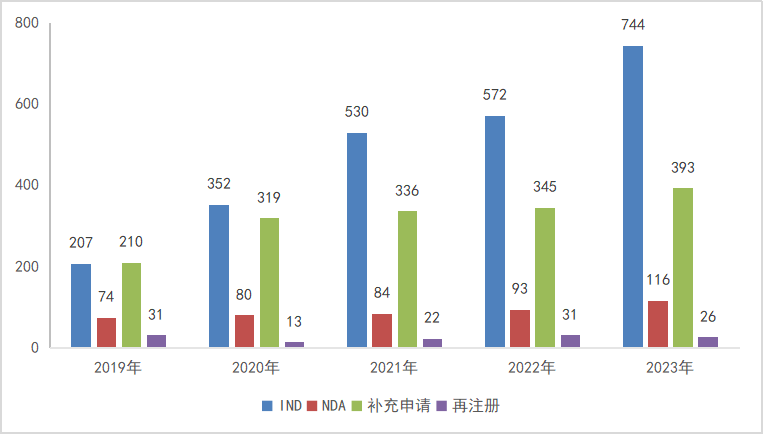
图16 2019-2023年生物制品注册申请受理情况
2023年受理生物制品1类创新药申请624品种(受理号891个),其中国产528个品种(受理号730个,其中预防用生物制品23个,治疗用生物制品707个);进口96个品种(受理号161个,其中预防用生物制品1个,治疗用生物制品160个);以审评任务类别统计,IND申请598个品种(受理号845个),NDA申请30个品种(受理号46个);2023年化药1类创新药注册申请受理情况详见图17。
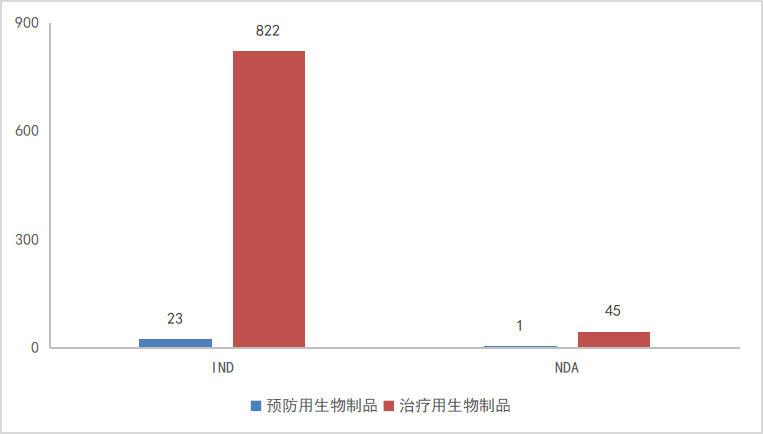
图17 2023年生物制品1类创新药注册申请受理情况
2、2023年生物制品完成审评情况
2023年CDE完成生物制品审评共1176个品种(受理号2066个);以审评任务类别统计,其中IND申请706个品种(受理号1021个),包含预防用生物制品40个,治疗用生物制品666个;NDA申请110个品种(受理号162个),包含预防用生物制品12个,治疗用生物制品98个;2023年生物制品各审评任务类别审结情况详见图18。
图18 2023年生物制品各审评任务类别审结情况
2023年生物制品创新药获批上市有17个品种(新冠药物除外),适应症包含实体瘤、宫颈癌等;2023年批准生物制品创新药详情见表8。
表8 2023年批准生物制品创新药

05
药品加快上市注册程序审评情况
1、优先审评审批情况
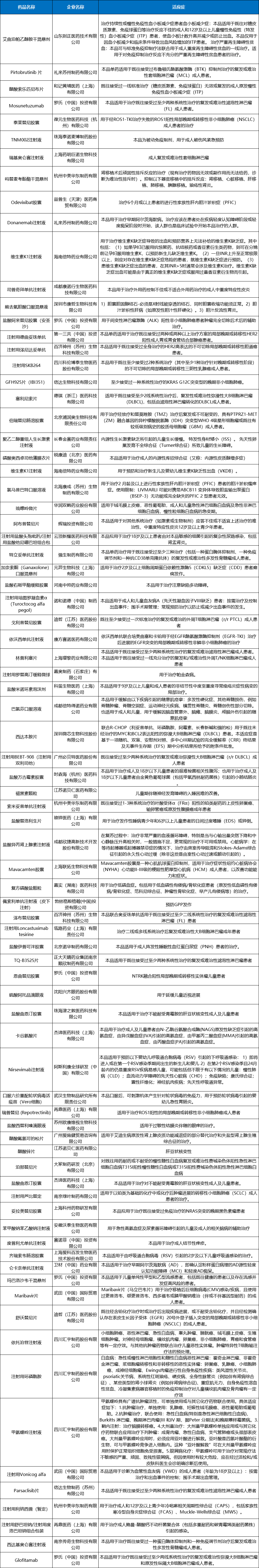
2023年CDE将81个品种(受理号109个,包括受理号暂无的数据)注册申请纳入优先审评程序,其中化药53个品种(受理号73个),生物制品22个品种(受理号28个),以及8个暂无受理号(7个品种)的数据;纳入理由包含符合附条件批准、儿童用药和纳入突破性治疗药物程序等;2023年纳入优先审评审批程序品种详情见表9。
表9 2023年纳入优先审评审批程序品种
2、突破性治疗审评情况
申请适用突破性治疗药物程序条件:药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等。
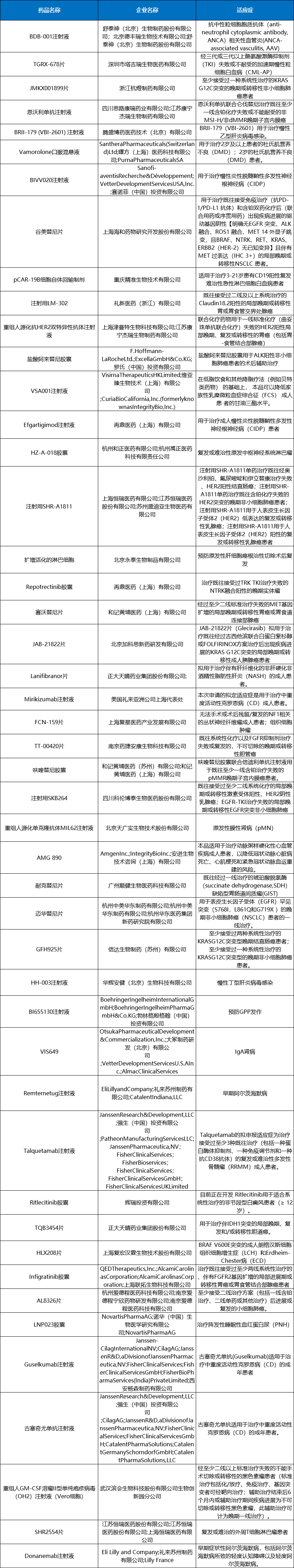
2023年CDE将48个品种(受理号70个)注册申请纳入突破性治疗药物程序,2023年纳入突破性治疗品种见表10。
表10 2023年纳入突破性治疗品种
数据来源:药智数据企业版——药品注册与受理数据库
如果这篇文章侵犯了您的权利,请联系我们。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx