眼科用药百亿蓝海市场,又有大单品杀入。
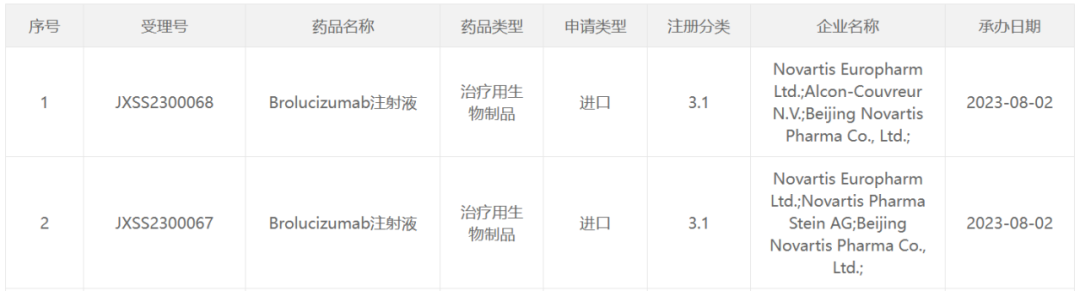
近日,诺华brolucizumab(布西珠单抗)注射液的上市申请已获CDE受理。布西珠单抗是新一代抑制VEGF的眼底血管病变治疗药物,此前已在美国获批用于湿性年龄相关性黄斑变性和糖尿病性黄斑水肿。
据悉,湿性年龄相关性黄斑变性和糖尿病黄斑水肿都是最常见的新生血管性眼病。糖尿病黄斑水肿是糖尿病性视网膜病变的一种严重的表现形式,研究表明,高血糖是其独立危险因素。高血糖会对眼部血管造成损伤,血液过度渗出而导致视网膜肿胀,表现为视野模糊、双重视觉、彩色斑点等,如果不加以干预,会导致视力的丧失。
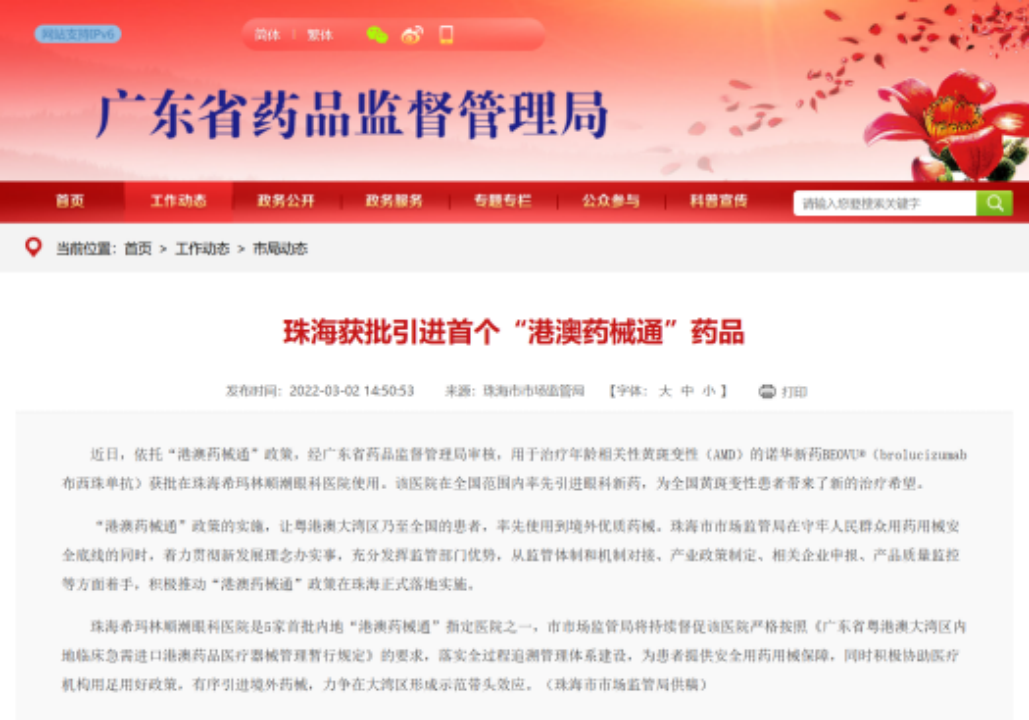
近年来,在人口老龄化趋势加剧、慢性病问题日益突出的背景下,我国眼底血管病变患病人数上升趋势强劲。基于临床未被满足的需求,2022年布西珠单抗作为临床急需药品,获批优先在中国粤港澳大湾区的医疗机构使用。
有业内人士指出,目前湿性年龄相关性黄斑变性、糖尿病视网膜病变、糖尿病黄斑水肿、视网膜静脉阻塞等在中国的知晓率还相对较低,大量的临床需求未被满足。不难想见,今后这一靶点将会越来越热,相关的眼科用药市场格局将面临新一轮的洗牌。
已上市产品收获颇丰
眼科市场红利仍在
从全球视角来看,目前共有5款抗VEGF药物获批上市。其中单抗类有罗氏/诺华的雷珠单抗(Ranibizumab,Lucentis)、诺华的Brolucizumab(Beovu);融合蛋白类有拜耳/再生元的阿柏西普(Aflibercept,Elyea)、康弘药业的康柏西普(Conbercept);双靶点抗VEGF药物有罗氏的Vabysmo(Faricimab,法瑞西单抗)。此外,雷珠单抗、阿柏西普和康柏西普三款药物已在中国获批上市。
三款已在中国获批的用于黄斑变性的VEGF药物中,诺华的雷珠单抗上市最早,2012年1月在国内获批。随后上市的是康弘药业的康柏西普。而2011年美国获批的拜耳阿柏西普,2018年才正式进入中国。
罗氏与诺华联合开发的雷珠单抗最早获批,其显著的疗效也使得抗VEGF药物在眼科治疗声名鹊起。米内网数据显示,2020年中国公立医疗机构终端眼科用药市场规模超过100亿元,2021年上半年其销售额增速接近30%。在2021H1中国公立医疗机构化学药终端眼科用药TOP10产品中,雷珠单抗以超48%的增长率和14%的市场份额位居榜首。
阿柏西普则是由再生元与拜耳共同研发的一种全人类的重组融合蛋白。虽然阿柏西普上市比雷珠单抗晚约5年,但阿柏西普卓越的疗效以及亲民的价格,短时间内就奠定了其在全球AMD领域的绝对优势地位。
阿柏西普上市的第一年销售额就达到了8.38亿美元;2021年,全球销售额更是达到93.85亿美元,市场占比已接近50%,成为名副其实的重磅炸弹。据悉,2022年阿柏西普销售额为96.47亿美元,是全球销售额最高的抗VEGF眼科药物。2023H1最新数据显示,阿柏西普共营收46.67亿美元。
康柏西普是本土企业康弘药业自主研发的一款抗VEGF受体与人免疫球蛋白Fc段基因重组的融合蛋白。自2013年在国内获批以来,康柏西普已经批准了3个适应症。康柏西普的上市,填补了国内眼底黄斑变性治疗药物的市场空白,打破了高价进口药对中国眼科市场的垄断。上市后的康柏西普凭借先发和性价比优势,实现快速放量。2015年—2022年,康柏西普所在的生物制品板块实现营收2.67亿元、4.76亿元、6.18亿元、8.82亿元、11.55亿元、10.87亿元、13.20亿元、13.66亿元,8年累计收入近72亿元。
此次获受理的brolucizumab是诺华研发的一款人源化单链抗体片段(scFv),分子量为26kDa,具有体积小、组织渗透性强、对VEGF-A异构体有强大抑制作用及高度亲和力。在临床试验HAWK和HARRIER试验中的数据显示,brolucizumab分别以87%和83%的概率,以12周的给药间隔成功维持至48周,即疗效可持续12周。Brolucizumab于2019年10月获FDA批准上市,用于wAMD的治疗。Evaluate Pharma预测,brolucizumab到2024年全球销售额有望达到13.2亿美元。
这一领域的“新贵”Vabysmo也展露出不俗的市场竞争力。据罗氏公布的2023H1业绩,其眼科产品VEGF-A/Ang2双抗Vabysmo(Faricimab,法瑞西单抗)收入增长迅猛,今年上半年销售收入达9.57亿瑞士法郎(约10.5亿美元),同比增长500%。
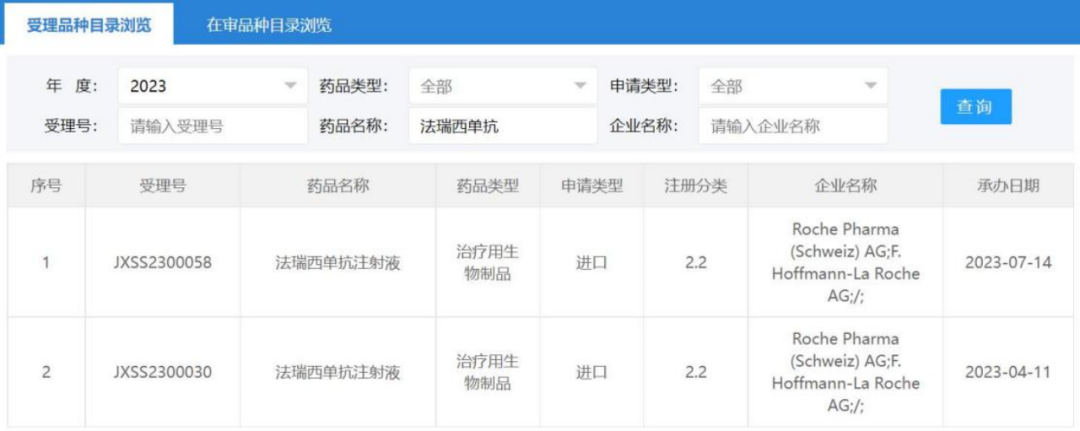
据悉,Vabysmo是首款针对眼科疾病获批的双特异性抗体,是首个在治疗糖尿病性黄斑水肿(DME)和湿性年龄相关性黄斑变性(wAMD)的III期研究中达到4个月间隔给药的药物。Vabysmo于2022年1月底首次获FDA批准上市,仅一年后便成长为一款“重磅炸弹”。值得注意的是,法瑞西单抗注射液在中国的上市申请,已经获得国家药监局药审中心(CDE)受理。
市场竞争日渐激烈
后来者虎视眈眈
据有关数据统计,2016年以来我国湿性老年性黄斑变性患者人数维持在3亿人以上,2016-2020年间年复合增长率为3.4%,预计到2030年增至4.9亿人。2016年以来,我国糖尿病黄斑水肿患者人数均超过6亿人,预计之后将以年复合增长率2.7%继续增长,到2030年增至8.9亿人。不难发现,在老龄化趋势加剧、糖尿病患病率逐年升高的语境下,湿性年龄相关性黄斑变性和糖尿病黄斑水肿患者人群将持续增长。
临床需求催生的市场空间使得国内外企业也纷纷瞄准这一潜力领域。随着阿柏西普和雷珠单抗的专利相继到期,国内外仿制药研发进入白热化阶段。2021年9月,美国FDA批准了Biogen/三星Bioepis联合研发的雷珠单抗生物类似药SB11。
在国内药企中,齐鲁无疑是细分领域的重要布局者。2022年4月,齐鲁制药提交了阿柏西普生物类似药QL1207的上市申请;今年1月,齐鲁制药提交的雷珠单抗生物类似药QL1205的上市申请获受理。
除此之外,在阿柏西普生物类似药中,博安生物的LY09004 、迈威生物的9MW0813也进入临床3期。一旦批准上市,国内眼科抗VEGF生物药领域将进入创新药和仿制药混战的局面,市场竞争将逐步加剧。
此外,新产品更新迭代速度明显加快。自罗氏的双抗药物上市以来,双靶点药物研发也逐渐成为这一领域重要研发方向之一。国内进展较快的包括信达生物的IBI302和荣昌生物的RC28-E。
2023年7月28日,信达在药物临床试验登记与信息公示平台登记了一项III期临床试验,旨在评估IBI302对比阿柏西普治疗nAMD的有效性和安全性。

据悉,IBI302IBI302是一款抗VEGF以及抗补体双靶点特异性重组全人源融合蛋白。该分子的N端能够阻断VEGF介导的信号通路,抑制血管内皮细胞的增殖、迁移、成管等,从而抑制血管新生,降低血管渗透性,减少血管渗漏;同时,其C端能够通过特异性结合C3b和C4b,抑制补体经典途径和旁路途径的激活,减轻补体介导的炎症反应。
在I期临床研究中,结果表明,IBI302具有良好的安全性和耐受性,患者接受治疗后视力明显改善且视网膜水肿也有所减少。IBI302的主要研究者孙晓东教授曾表示,IBI302作为全球创新的抗VEGF-抗补体双靶点分子,除了提高视力和改善网膜水肿之外,还有望在视网膜纤维化和黄斑萎缩的预防以及控制上给患者带来更多积极的获益。
RC28-E则是荣昌开发的首创VEGF/FGF(成纤维细胞生长因子)双靶标融合蛋白药物。在Ib期剂量扩大试验中,结果显示,RC28-E在湿性黄斑变性患者中展现出良好的耐受性和安全性,显著改善了患者的视力和病情。并且,对于此前接受抗VEGF药物治疗和眼底息肉状脉络膜血管病变(PCV)的患者,RC28-E均展现出疗效。
据悉,目前RC28-E正在进行III期临床研究,旨在评估RC28-E治疗湿性年龄相关性黄斑变性患者的有效性和安全性。据有关数据预测,若RC28-E的湿性黄斑变性、糖尿病黄斑水肿两个适应症能在2026年初上市,预估2026年、2027年国内销售额合计约可达到2.1亿元和5.41亿元。
据光大证券发布的研究报告,我国VEGF类药品眼科渗透率仅1.15%,而美国市场的渗透率约为6%-7%。假设到2025年,我国VEGF药品在眼科的渗透率和使用频率达到美国的水平,届时我国VEGF药品眼科市场空间将超过百亿,不难感受到,抗VEGF药物市场巨大的潜力和价值。眼科用药领域是长期的黄金赛道,国内人口基数大,需求大,有较大的发展空间,在VEGF类药品赛道上,目前国内还是一片蓝海,药品研发速度以及创新性和差异化,必将成为未来脱颖而出的关键。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx