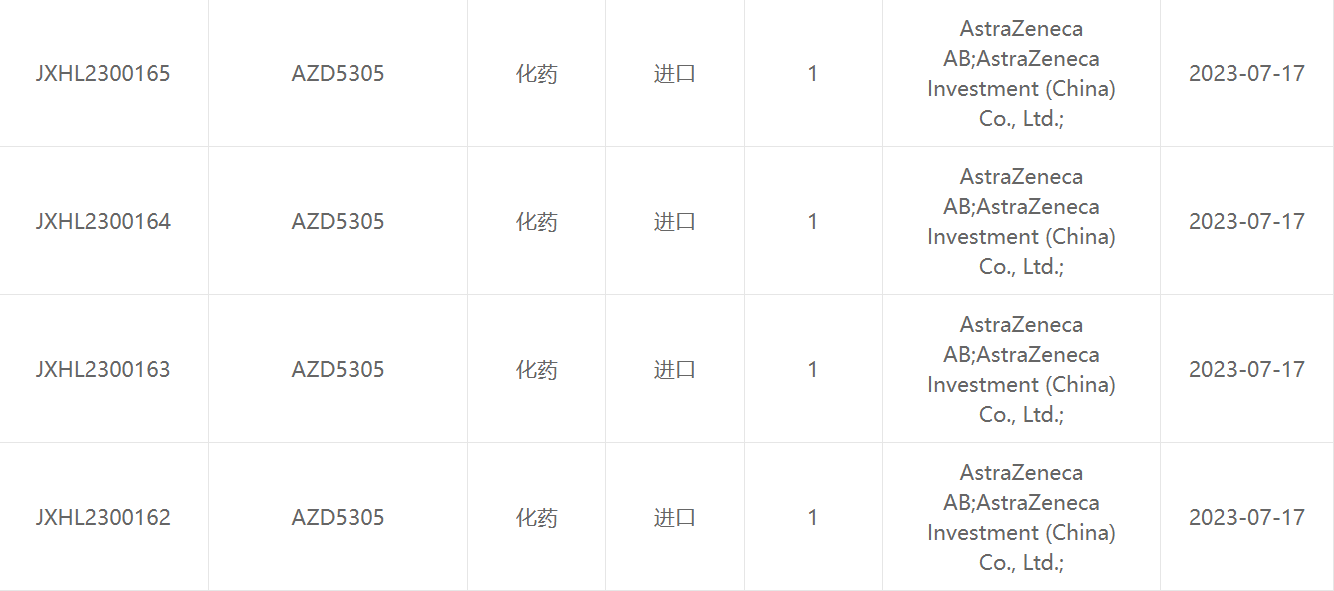
日前,据国家药品监督管理局药品审评中心(CDE)官网显示,阿斯利康两款1类新药临床申请获受理。分别是口服雌激素受体降解剂AZD9833片和PARP1抑制剂AZD5305。


AZD9833(camizestrant)是阿斯利康研发的下一代口服雌激素受体降解剂(SERD),于2021年8月首次在国内启动临床,目前在全球范围内处于 III 期临床阶段,用于 ER+ HER2- 的乳腺癌患者。
AZD5305是阿斯利康的第2款 PARP1 选择性抑制剂,于2022年3月在国内首次启动临床,开展在晚期恶性肿瘤患者中的国际多中心 I/IIa 期临床试验,以评估AZD5305剂量递增单药治疗和与抗癌药物联合治疗的安全性和有效性。
此外,还有四川汇宇、迈同生物、揽月生物、微芯生物等新药申报进展。
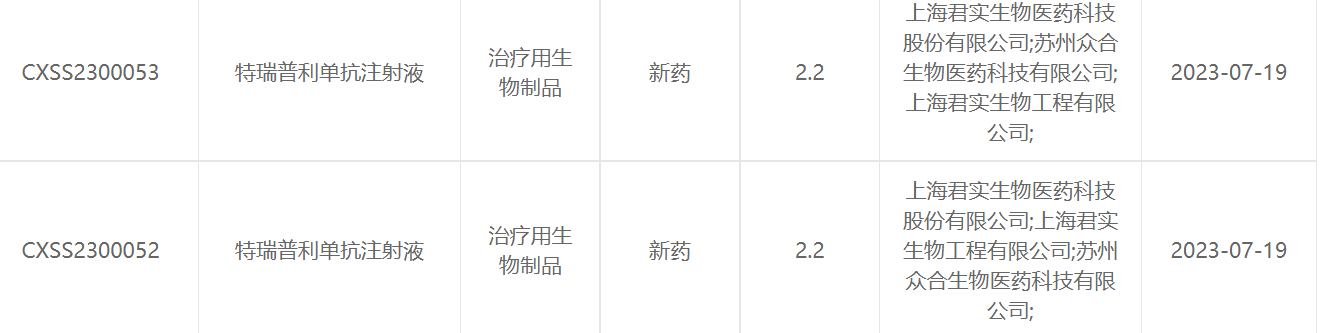
君实生物宣布,中国国家药品监督管理局药品审评中心(CDE)受理了抗PD-1单抗药物特瑞普利单抗的新适应症上市申请,联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗。公开资料显示,这是特瑞普利单抗在中国递交的第10项上市申请。
特瑞普利单抗注射液是以PD-1为靶点的单抗药物,至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖数十项由公司发起的临床研究,涵盖肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等瘤种。截至目前,特瑞普利单抗的6项适应症已于中国获批,其中3项适应症已被纳入中国国家医保目录(2022年版)。今年以来,该产品针对非小细胞肺癌(NSCLC)、三阴性乳腺癌以及肾细胞癌一线治疗的新适应症上市申请又先后获得CDE受理。
本次特瑞普利单抗的新适应症上市申请主要基于EXTENTORCH研究。这是一项随机、双盲、安慰剂对照、多中心的3期临床研究,由吉林省肿瘤医院程颖教授担任主要研究者,在中国51家临床中心联合开展。该研究旨在比较特瑞普利单抗或安慰剂联合依托泊苷及铂类在一线治疗ES-SCLC的有效性和安全性。
四川汇宇HYP-2090PTSA申报临床

汇宇制药公告称,全资子公司四川汇宇海玥的1类新药HYP-2090PTSA胶囊临床申请获得受理。HYP-2090PTSA胶囊用于治疗KRASG12C突变的晚期实体瘤,这是汇宇制药首款申报临床的1类新药。
1类新药HYP-2090PTSA是汇宇制药全资子公司汇宇海玥自主研发的KRASG12C/PI3K双靶点小分子抑制剂,用于治疗KRASG12C突变的晚期实体瘤(如非小细胞肺癌、结直肠癌、胰腺癌等),国内外尚无同类产品获批上市。
迈同生物MT-001胶囊申报临床

迈同生物研发的靶向IDH1抑制剂MT-001化药1.1类IND申报已获CDE正式受理,受理号CXHL2300797和CXHL2300798 ,主要用于IDH1突变的实体瘤(脑胶质瘤和胆管癌等)和血液瘤。
前期的研究结果表明,MT-001具有高选择性,安全性良好,药效优异以及良好的血脑屏障透过率等特点,它可与IDH1突变体酶活性位点结合,选择性抑制突变体IDH1-R132C/H/L/S/G,且对野生型IDH1无抑制,对正常细胞无影响,但同时可大大抑制IDH1突变体的酶活性。针对IDH1突变高发的脑胶质瘤、胆管癌、AML和软骨肉瘤等多种目前尚无有效手段治疗的肿瘤治疗打开了新的路径,提供了新的可能。也为未来产品的license out奠定强有力的基础。
揽月生物SKG0106眼内注射溶液申报临床

九天生物(Skyline Therapeutics)旗下揽月生物医药科技有限公司(以下简称“揽月生物”)自主研发的基因治疗药物SKG0106眼内注射溶液申报已获CDE正式受理。
SKG0106眼内注射溶液是九天生物开发的一款在研的创新眼科基因治疗药物,由该公司开发的新型腺相关病毒(AAV)衣壳和其独创的抗新生血管生长的转基因组成。其作用机制是:通过单次玻璃体腔注射将SKG0106递送至眼内,在转导视网膜细胞后表达抗新生血管生长基因产物,从而抑制与眼底新生血管相关的疾病进展。在临床前研究中,SKG0106显示出了良好的靶组织专一性、转导性和生物分布,以及抑制眼内新生血管生长具有高效性、持久疗效和良好安全性等特点。
微芯生物西达本胺片新适应症申报上市

由微芯生物研发的亚型选择性组蛋白去乙酰化酶(HDAC)口服抑制剂西达本胺联合R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和强的松)用于既往未经治疗的MYC和BCL2表达阳性的弥漫大B细胞淋巴瘤(DLBCL)患者的上市申请获得中国国家药监局(NMPA)受理。
西达本胺(chidamide;商品名:爱谱沙/Epidaza)是微芯生物发现的一款通过口服的亚型选择性组蛋白去乙酰化酶(HDAC)抑制剂,它对肿瘤抑制性免疫微环境具有重新激活作用,可单独或联合其他药物解决严重威胁人类健康的恶性肿瘤等重大疾病。
目前,西达本胺在中国大陆已有外周T细胞淋巴瘤和乳腺癌两个适应症获批上市,在中国台湾地区有乳腺癌适应症获批上市,在日本有成人白血病和外周T细胞淋巴瘤两个适应症获批上市。此外,该产品正在开展全球多中心一线黑色素瘤3期临床试验,以及联合不同抗肿瘤免疫治疗的多项临床试验。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx