6月30日,中国国家药监局(NMPA)批准合肥亿帆生物制药有限公司申报的3类化学药品氯法拉滨注射液上市,适用于既往至少接受过两种方案治疗且无其他治疗手段可达持续应答的1-21岁复发性或难治性急性淋巴细胞白血病(ALL)患者。氯法拉滨为2023年5月26日国家卫健委药物政策与基本药物制度司公布的《第四批鼓励研发申报儿童药品建议清单》之一,是中国大陆境内尚未注册上市且临床急需的儿童用药,该产品的获批上市将为白血病患儿带来福音。
关于氯法拉滨
氯法拉滨为细胞毒类抗肿瘤药,氯法拉滨(Clofarabine)结合了同类药物氟达拉滨(Fludarabine)和克拉屈滨(Cladribine)的优点,并克服其缺点,既能抑制DNA聚合酶,又抑制核糖核苷酸还原酶,终止DNA链的延长及修复;克服了对酸不稳定和溶解性不良。
氯法拉滨在细胞内依次被脱氧胞苷激酶和单、二磷酸激酶代谢为5′-单磷酸盐代谢物,成为有活性的5′-三磷酸盐代谢物。氯法拉滨对活化磷酸化酶脱氧胞苷激酶具有亲和力,等于或大于天然底物脱氧胞苷。氯法拉滨通过对核糖核苷酸还原酶的抑制作用来减少细胞脱氧核苷三磷酸池,并通过竞争性抑制DNA聚合酶来终止DNA链延长,通过掺入DNA链来抑制修复,从而抑制DNA合成。三磷酸氯法拉滨对这些酶的亲和力与三磷酸脱氧腺苷相似或更高。在临床前模型中,已证实氯法拉滨在修复过程中通过掺入DNA链抑制DNA修复的能力。氯法拉滨5′-三磷酸还破坏线粒体膜的完整性,导致促凋亡线粒体蛋白、细胞色素C和凋亡诱导因子的释放,引起程序性细胞死亡。氯法拉滨在体外对快速增殖和静止的癌细胞类型具有细胞毒 性。
氯法拉滨最早由美国Bioenvision公司开发,鉴于其在II期临床试验中显著的疗效,美国FDA于2004年12月28日通过快速通道批准氯法拉滨用于儿童及青少年(年龄1~21岁)急性淋巴细胞性白血病(ALL)的治疗,由Genzyme公司生产,商品名为CLOLAR®。氯法拉滨 (Clofarabine)是第二代嘌呤核苷类似物,近期临床试验表明,应用氯法拉滨替代柔红霉素和依托泊苷能改善患儿的临床预后,同时能降低心脏毒 性和继发性肿瘤的风险,因此,氯法拉滨是复发/难治性ALL患儿的一种有效、耐受良好的新治疗选择。
氯法拉滨国内研发情况
在我国小儿恶性肿瘤中,以白血病的发病率最高。15岁以下小儿白血病的发病率为2.73/10万,全国每年新增儿童白血病患者2万多人,儿童急性淋巴细胞白血病(ALL)在儿童白血病中占75%之多,每年新增1.5万多例病例。发病高峰在3岁-7岁之间,随着环境污染加剧,发病人数还在增加。从治疗效果看,发达国家儿童ALL治愈率高达80%,发展中国家治愈率仅35%以下。即发展中国家理论上ALL患病人群中的65%适用该本品的治疗,按照1.5万年新增病例看,每年新增9750例氯法拉滨治疗人群。
根据IQVIA数据库显示,2020年氯法拉滨全球市场规模约2.02亿元,全球销量约1.57万支。近年来,国内氯法拉滨申报上市的企业大概有10多家,截止目前,仅有合肥亿帆一家成功获批,其他公司的均已夭折。大概在2006年时,恒瑞就已经申报上市,原研健赞公司,也在2009年,提交过上市申请,最后均是断送在襁褓中。随着潜在适应症的不断扩大和国家利好政策的催化作用下,未来我国儿童用药市场潜力巨大,氯法拉滨注射液市场前景良好。
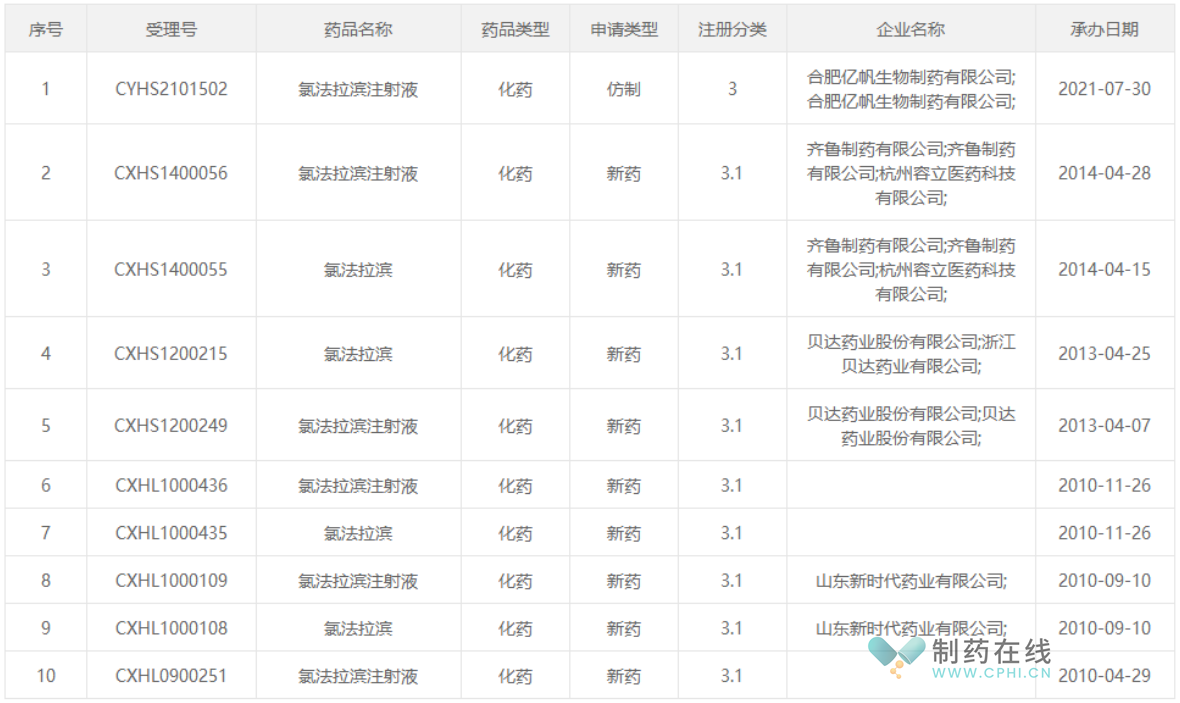
来源:CDE官网
参考来源
1.CDE官网
2.亿帆医药股份有限公司关于获得药品注册证书的公告. Retrieved June 30,2023, from https://pdf.dfcfw.com/pdf/H2_AN202306291591879328_1.pdf?1688063880000.pdf
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx