2022年2月,中国国家药监局药品审评中心(以下简称CDE)发布《真实世界证据支持药物注册申请的沟通交流指导原则(试行)》和《药物真实世界研究设计与方案框架指导原则(试行)》,以科学合理地设计真实世界研究,促进真实世界证据在药品注册申请中的应用实践,提高研发效率,自发布之日起施行,真实世界研究这一系列的政策出台,标志着真实世界研究的政策春天看似已经来临,但要将药品真实世界数据研究工作步入规范化、长效化轨道,中国本土化的实践仍任重而道远。
真实世界研究助力创新药获批上市
真实世界研究(RWS):是指针对预设的临床问题,在真实世界环境下收集与研究对象健康有关的数据(真实世界数据)或基于这些数据衍生的汇总数据,通过分析,获得药物的使用情况及潜在获益-风险的临床证据(真实世界证据)的研究过程,药品真实世界研究是新兴事物,国内是摸着石头过河的探索,随着研发理念更新和创新技术进步,对真实世界数据的有效利用日益受到关注,2018年10月,CDE使用真实世界数据支持药品审评决策的首次尝试,即基于真实世界数据扩展了贝伐珠单抗注射液的适应症;2021年3月,首 个试点品种普拉替尼胶囊获批上市,NMPA通过优先审评审批程序附条件批准1类创新药普拉替尼胶囊(商品名:普吉华)上市。
构建中国特色的真实世界
证据指导原则体系
近年来,如何利用真实世界证据用以评价药物的有效性和安全性,成为国内外药物研发中日益关注的热点问题,是药物研发的一种策略和路径,美国于2016年12月通过《21世纪治愈法案》,鼓励美国FDA开展研究并使用真实世界证据支持药物和其它医疗产品的监管决策,加快医药产品开发;EMA于2014年启动了适应性许可试点项目,探索利用真实世界数据包括观察性研究数据等用于监管决策的可行性。
如何通过科学严谨的方法将真实世界数据转化为真实世界证据,是目前药品研发和监管相关方共同面临的挑战,我国CDE自2018年开始启动真实世界研究相关工作,近几年在制定技术指导原则、开展应用试点以及建立工作机制等方面取得积极成效,笔者梳理如下,如有遗漏,欢迎大家留言补充。
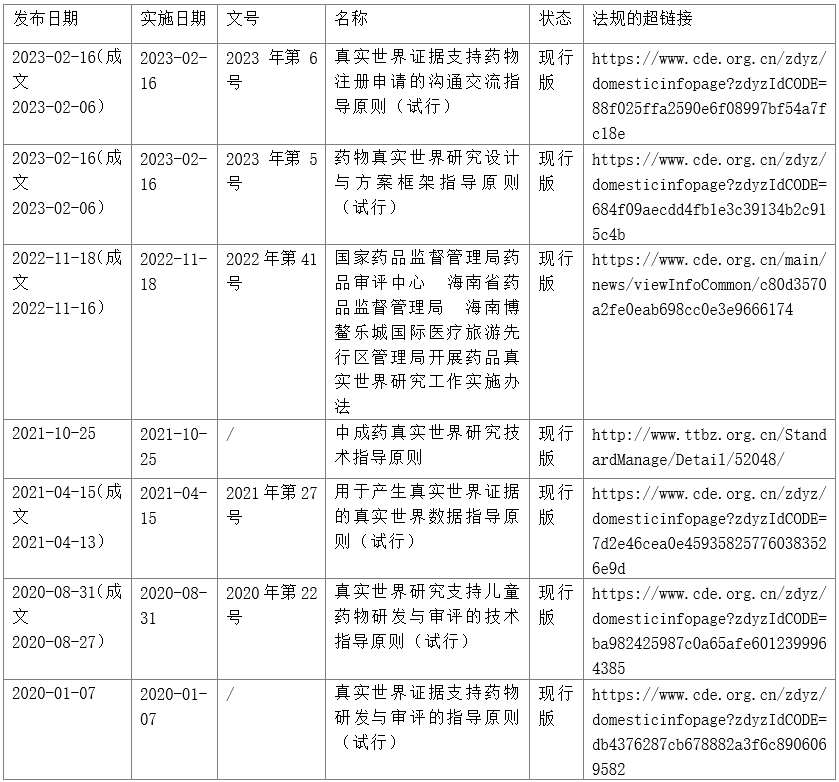
真实世界研究的相关政策法规如何落地?
1.“RWS一号文”来了 ——《真实世界证据支持药物研发与审评的指导原则(试行)》
2020年1月7日,CDE组织专家进行了广泛而深入的研讨,颁布实施了《真实世界证据支持药物研发与审评的指导原则(试行)》,这是自2018年开始启动真实世界研究相关工作,是我国真实世界研究(RWS)领域第一个指导原则,引发国内乃至全球医药学术、工业界的广泛关注,也获得高度认可。明确了真实世界研究的地位和作用,对中国真实世界研究的开展具有重大意义,该指导原则介绍了真实世界研究的背景和目的、相关的定义、真实世界证据对药物监管决策的作用、真实世界研究的基本设计、真实世界证据的评价以及与审评机构的沟通交流。本指南旨在厘清药物研发和监管决策中真实世界证据的相关定义,指导真实世界数据收集以及适用性评估,明确真实世界证据在药物监管决策中的地位和适用范围,探究真实世界证据的评价原则,为工业界和监管部门利用真实世界证据支持药物监管决策提供参考意见。本指导原则仅代表当前的观点和认识,随着研究和认识的深入将不断修订和完善。
2.助力儿童用药研发——《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》
2020年8月27日,国家药监局颁布了《真实世界研究支持儿童药物研发与审评的技术指导原则(试行)》,本指导原则着重介绍现阶段真实世界研究支持我国儿童药物研发时的常见情形及关注点,有关真实世界研究的基础概念、基本原则、研究设计及统计方法学等内容,请参考《真实世界证据支持药物研发与审评的指导原则(试行)》。该指导原则适用于各类别儿童用药,包括化学药品、中药及生物制品。将我国上市的临床常用药品,使用超说明书用药数据支持适应症扩展至儿童应用。此外,为了充分利用儿童医疗机构数据资源,采用真实世界研究方法进一步解决儿童用药研发困境,药审中心联合海南省真实世界数据研究院和国内儿童医疗机构开展研究,积极促进将“经验性给药”转化为药品说明书信息,指导儿科安全合理用药。着重介绍现阶段真实世界研究支持我国儿童药物研发时的常见情形及关注点,有关真实世界研究的基础概念、基本原则、研究设计及统计方法学等内容。
3.“RWD一号文”来了 ——《用于产生真实世界证据的真实世界数据指导原则(试行)》
2021年4月15日,国家药监局颁布了《用于产生真实世界证据的真实世界数据指导原则(试行)》,是我国真实世界数据(RWD)领域又一重要文件。是《真实世界证据支持药物研发与审评的指导原则(试行)》配套和补充,将从真实世界数据的定义、来源、评价、治理、标准、安全合规、质量保障、适用性等方面,对真实世界数据给出具体要求和指导性建议,以帮助申办者更好地进行数据治理,评估真实世界数据的适用性,为产生有效的真实世界证据做好充分准备。
4.探索中药真实世界证据支持监管决策——《中成药真实世界研究技术指导原则》
2021年10月25日,全国团体信息平台发布了由中国中药协会等组织起草的《中成药真实世界研究技术指导原则》(T/CATCM 011—2021)团体标准,此团体标准是为了保证中成药真实世界研究的规范性,将有助于研究者规范、合理、科学地开展研究,促进我国高质量中成药真实世界证据的生产与使用,有力推动中成药产业发展,符合国际标准又适应中国国情和中成药特色,弥补了国内中成药真实世界研究领域的空白。中成药真实世界研究是指围绕中成药的具体研究问题,综合信息学、流行病学、统计学、经济学等多学科方法技术,基于真实世界数据开展的研究,《中成药真实世界研究技术指导原则》主要章节内容针对各种常见的真实世界研究方法,从研究立题、方法选择、数据收集、数据处理、统计分析、经济学评价等方面,结合中成药自身特点,进行了细致的阐述和科学指导,原则适用于我国基于真实世界数据的中成药有效性、安全性及经济性评价参考。CDE交流会透露CDE也正在进行了积极探索,正在筹备中药研发中运用真实世界证据的指导原则,不久将公开征求业界意见。
5.RWS用于注册了——《国家药品监督管理局药品审评中心 海南省药品监督管理局 海南博鳌乐城国际医疗旅游先行区管理局开展药品真实世界研究工作实施办法》
2022年11月18日,CDE会同海南省药监局、乐城管理局联合修订了《国家药品监督管理局药品审评中心 海南省药品监督管理局 海南博鳌乐城国际医疗旅游先行区管理局开展药品真实世界研究工作实施办法》,自发布之日(2022年11月18日)起施行,《实施办法》明确了三方的职责和分工,确定了申报标准和格式,进一步规范了申报程序、沟通交流程序,指出了6种应退出试点的情形,并采取5条保障措施,确保各项工作要求落地落实落细。
6.RWS方案撰写指南——《药物真实世界研究设计与方案框架指导原则(试行)》
2023年2月16日,CDE发布《药物真实世界研究设计与方案框架指导原则(试行)》的通告(2023年第5号),本文曾于2022年7月7日发布《药物真实世界研究设计与方案框架指导原则(征求意见稿)》,为了指导申办者科学合理的设计真实世界研究,明确真实世界研究方案撰写的技术要求,本指导原则将重点阐述药物研发及评价中真实世界研究设计以及研究方案制订的基本考虑,为药物研发中开展真实世界研究提供指导意见。该指导原则适用于通过真实世界研究获得药物评价的临床证据。真实世界证据支持药物研发和监管决策的适用情形参见《真实世界证据支持药物研发与审评的指导原则(试行)》。本指导原则也可供以非注册研究为目的的真实世界研究参考。本指导原则将重点阐述药物研发中真实世界研究设计以及研究方案制订的基本考虑,为药物研发中开展真实世界研究提供指导意见。
7.助力沟通交流——《真实世界证据支持药物注册申请的沟通交流指导原则(试行)》
2023年2月16日,CDE发布《真实世界证据支持药物注册申请的沟通交流指导原则(试行)》的通告(2023年第6号),本文曾于2022年8月7日发布《真实世界证据支持药物注册申请的沟通交流指导原则(征求意见稿)》,利用真实世界证据支持药品注册,需要与药品审评机构进行充分的沟通交流,以确保双方对使用真实世界证据以及开展真实世界研究等方面达成共识。本指导原则在《药品注册管理办法》、《药物研发与技术审评沟通交流管理办法》基础上,明确了使用真实世界证据支持注册申请时,沟通交流要讨论的核心问题、会议资料要求等,为申办者在关键时间节点开展沟通交流提供建议,以提升药物临床研发效率。适用于将真实世界证据作为有效性和/或安全性评价的关键证据来支持药物注册申请时的沟通交流,具体流程按照《药物研发与技术审评沟通交流管理办法》进行管理实施。本指导原则将重点阐述申请人使用真实世界证据在关键时间节点与审评机构开展沟通交流时应聚焦的核心问题,指导申请人做好沟通前充分的准备工作,以提升沟通和研发效率。
参考文献
[1] 国家药监局、海南省药监局及CDE网站等
如果这篇文章侵犯了您的权利,请联系我们。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx