本周看点
1.恒瑞PD-L1抗体阿得贝利单抗获批上市
2.两款生物类似药获批上市,来自正大天晴、海正生物
3.扬子江药业1类新药上市申请获受理
4.基石药业PD-L1申报新适应症
本期(2023年2月24日至2023年3月3日),3款单抗获批上市,包括恒瑞医药的PD-L1抗体阿得贝利单抗、海正生物的曲妥珠单抗生物类似药、正大天晴的贝伐珠单抗生物类似药。本周还有多款新药申报上市,来自扬子江药业、基石药业、再鼎医药等,更多动态如下:
国内审评审批·新动态
本期CDE有36个受理号(27个品种)报生产办理状态更新,其中恒瑞医药的阿得贝利单抗注射液、海正生物的注射用曲妥珠单抗和正大天晴的贝伐珠单抗注射液备受关注,更多动态如下:
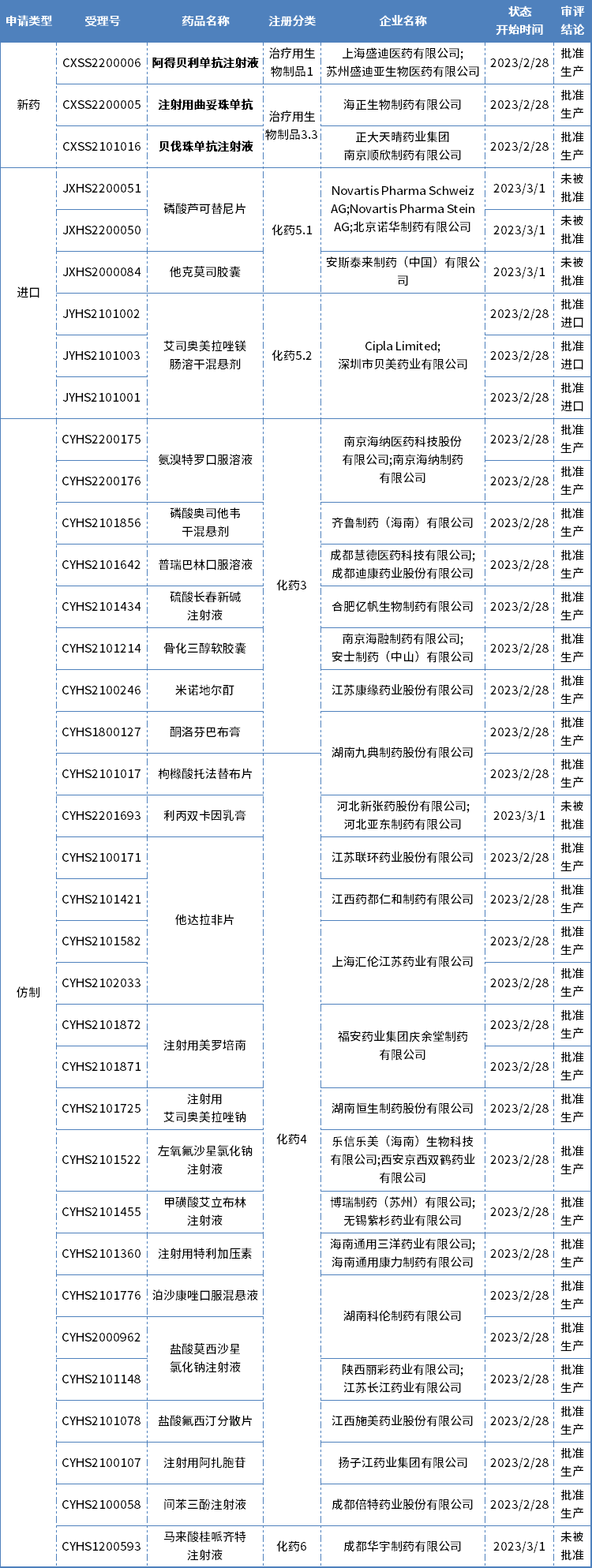
数据来源:药智数据
恒瑞PD-L1抗体阿得贝利单抗获批上市
2月28日,恒瑞医药自主研发的抗PD-L1单抗阿得贝利单抗(SHR-1316)注射液获批上市,为本就严重内卷的PD-1/PD-L1抗体药物市场再添一把火。恒瑞医药成为全球唯一一家同时拥有PD-1和PD-L1两大单抗的药企,堪称“卷王”。
阿得贝利单抗是恒瑞医药研发的人源化抗PD-L1单克隆抗体,能特异性结合PD-L1分子,从而阻断导致肿瘤免疫耐受的PD-1/PD-L1通路,重新激活免疫系统的抗肿瘤活性,达到治疗肿瘤的目的。根据公开资料,该药本次获批的适应症为联合化疗一线治疗广泛期小细胞肺癌(ES-SCLC)。目前,阿得贝利单抗还有多项临床研究正在进行,以评估其在各类实体肿瘤中的抗肿瘤作用。
截至目前,国内获批上市的PD-1/PD-L1抗体药物已有16款,其中包含10款PD-1单抗(8款国产,2款进口),5款PD-L1单抗(3款国产,2款进口),1款国产PD-1/CTLA4双抗。
此前恒瑞已有PD-1单抗卡瑞利珠单抗,于2019年5月获批上市,目前已在肺癌、肝癌、食管癌、鼻咽癌以及淋巴瘤等瘤种中获批9个适应症,是目前获批适应症数量和医保覆盖范围领先的国产PD-1产品之一。
本次恒瑞医药PD-L1单抗成功获批,将有助于其在内卷的PD-1/PDL-1赛道打开差异化的新市场空间。
两款生物类似药获批上市
曲妥珠单抗,是由基因泰克(罗氏的子公司)研发的一种人源化IgG1κ型单克隆抗体,能够特异性的作用于人表皮生长因子受体-2(HER2)的胞外区,阻止细胞内酪氨酸激酶的活化,抑制依赖HER2的肿瘤细胞的增殖和存活。此外,它还能通过抗体依赖的细胞介导的细胞毒反应(ADCC)对肿瘤细胞进行杀伤。原研产品赫赛汀最早于1998年9月25日获得美国食品药品管理局(FDA)批准。
目前国内已有两款曲妥珠单抗生物类似药获批上市,分别来自复宏汉霖和本周获批的海正生物,此外安科生物和正大天晴也已提交上市申请,目前还在审评审批中。
贝伐珠单抗,是罗氏研发的一款抗血管内皮细胞生长因子单克隆抗体(抗VE GF mAb),通过阻断VE GF与其血管内皮细胞表面上的受体结合,阻断PI3K-Akt/PKB和Ras-Raf-MEK-ERK等信号通路的传导,从而抑制血管内皮细胞的生长、增殖、迁移以及血管新生,降低血管渗透性,阻断肿瘤组织的血液供应,抑制肿瘤细胞的增殖和转移,诱导肿瘤细胞凋亡,从而达到抗肿瘤的治疗效果。原研安维汀2004年2月首次获FDA批准上市,目前已在全球已经获批多个适应症。
目前国内已有9款贝伐珠单抗生物类似药获批上市,分别来自齐鲁制药、信达生物、恒瑞医药、博安生物、百奥泰、海正生物/贝达生物、东曜药业、复宏汉霖和正大天晴。此外,神州细胞也已经递交上市申请,竞争异常激烈。
国内审评审批·新受理
本期CDE新增报生产受理号68个,共50个品种,其中扬子江药业的盐酸妥诺达非片、基石药业的舒格利单抗注射液和再鼎医药的注射用舒巴坦钠/注射用度洛巴坦钠组合包装备受关注,更多动态见下表:
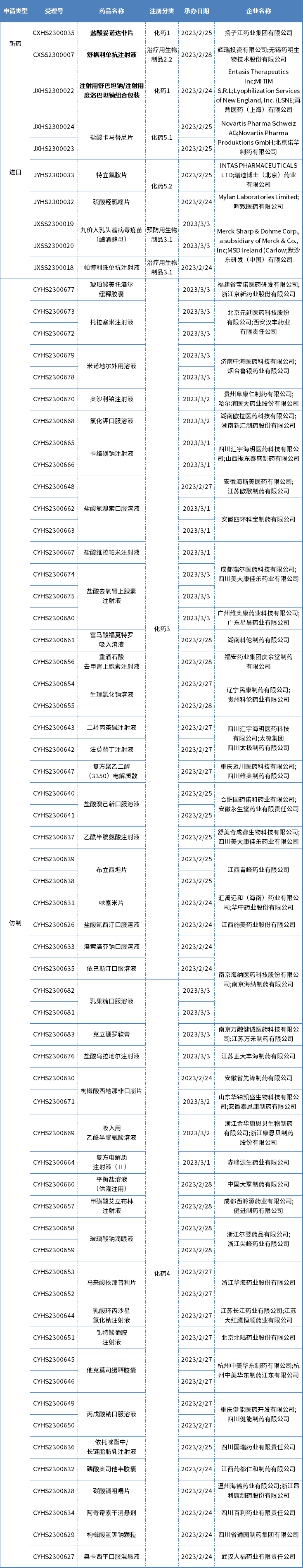
数据来源:药智数据
扬子江药业1类新药上市申请获受理
药智数据显示,扬子江药业提交的1类新药盐酸妥诺达非片上市申请获药监局受理。根据公开资料推测,该药是一种磷酸二酯酶5(PDE5)抑制剂,适应症为勃起功能障碍(ED)的治疗。
2021年5月,扬子江药业的首 款1类新药注射用磷酸左奥 硝唑酯二钠获批上市,本次是扬子江药业提交上市申请的第二个1类新药。此外,扬子江药业还有8个1类新药获批临床,包括6款化药新药和2款中药新药。
基石药业PD-L1申报新适应症
近日,舒格利单抗注射液(择捷美)新适应症上市申请获CDE受理。据基石药业新闻稿该适应症为联合化疗一线治疗不可手术切除的局部晚期或转移性胃/胃食管结合部腺癌。这是舒格利单抗在国内申报的第4项适应症。
舒格利单抗是由基石药业开发的抗PD-L1单克隆抗体,与同类药物相比舒格利单抗在患者体内产生免疫原性及相关毒 性的风险较低。
此前,国家药监局已批准舒格利单抗用于治疗III期和IV期非小细胞肺癌、复发或难治性结外NK/T细胞淋巴瘤。此外,舒格利单抗用于治疗复发难治性结外NK/T细胞淋巴瘤(R/R ENKTL)的新适应症上市申请获NMPA受理并纳入优先审评。
再鼎医药引进的抗感染新药申报上市
近日,再鼎医药引进的舒巴坦钠-度洛巴坦钠(SUL-DUR)新药上市申请获CDE受理。据悉,SUL-DUR是一款静脉注射型的组合抗生素新药,结合舒巴坦钠(一种β-内酰胺类抗生素)和度洛巴坦钠(一种新型广谱β-内酰胺酶抑制剂),用于治疗鲍曼不动杆菌(包括多重耐药和耐碳青霉烯类(CRAB)菌株)引起的感染。此前,CDE已将该申请纳入优先审评。
2022年11月,美国FDA已受理SUL-DUR纳入优先审评的上市申请,处方药用户付费法案(PDUFA)的目标行动日期为2023年5月29日。本次SUL-DUR在国内申报上市,有望为更多中国患者带来新的治疗选择。
数据来源:药智数据、企业公告等网络公开数据
信息来源:药智网、企业公告等网络公开信息
如果这篇文章侵犯了您的权利,请联系我们。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx