创新药研发向来九死一生,Claudin18.2靶点更是如此。不过不久前,日本药企安斯泰来带来了好消息。其研发的Claudin18.2抗体——IMAB362 III期临床试验获得成功,打破了此前Claudin18.2药物III期临床成功率零的记录。
目前,Claudin18.2已成为继PD-1/L1之后又一个内卷靶点。据不完全统计,国内当前就有50多款Claudin18.2靶向药处于研发阶段。那么Claudin18.2为何受到国内药企的青睐?对于当下十分有希望拿下“FIC桂冠”的IMAB362来说,它所面临的危机又有哪些?国内玩家谁将有希望率先突围?
热门靶点——Claudin 18.2
Claudins是一类紧密连接蛋白,主要参与维持细胞间粘附及连接。Claudin 18作为Claudins蛋白家族中的一员,共有两种亚型:Claudin 18.1和Claudin 18.2。其中Claudin 18.1主要表达在正常肺部细胞,Claudin 18.2(CLDN 18.2)则仅在胃黏膜已分化的上皮细胞表达。
正常生理条件下,CLDN 18.2的表达十分有限,但在胃癌、胰 腺癌、食管癌等肿瘤中表达较高且异位激活。在胃癌人群中,CLDN 18.2表达阳性的患者约占16%-73%。因此,CLDN 18.2也成为胃癌新药开发的靶标。
我国是胃癌大国。据国家癌症中心2022年发布的统计数据显示,2016年我国有近40万新确诊胃癌患者,发病率位列我国肿瘤TOP3。据中国国家公立医院的化学药品终端监测和分析系统(HDM)统计,2016年中国重点城市公立医院的胃癌治疗药物仍然以化疗药物为主,其市场总额为9.45亿美元,同比上一年增长12.24%。预计到2030年,总规模将达到40亿美元。面对庞大的市场,已获批上市的治疗药物却屈指可数。目前,上市的生物药只有抗HER-2、抗PD-(L)1、抗VEGFR靶向药。而HER2阳性的胃癌患者仅占7.3-20.2%,PD-L1阳性率为12-50%,VEGF阳性率为72%,而CLDN18.2阳性率为60-80%。因此靶向CLDN18.2的药物市场可期,CLDN18.2也成为国内药企纷纷布局的热门靶点。
IMAB362有望摘下“FIC桂冠”,但仍有缺陷
IMAB362最初由Ganymed公司研发,是一款靶向CLDN18.2的单抗药物。其作用机理为:通过抗体的Fab段与肿瘤细胞表面抗原决定簇特异性结合后,再通过抗体Fc段与NK细胞等效应细胞结合,触发其杀伤活性,直接杀伤肿瘤细胞。
在2016年ASCO会议上,Ganymed公司报告了IMAB362的研究结果。据报道,IMAB362联合标准化疗方案EOX(表柔比星、奥沙利铂、卡培他滨)作为一线用药治疗CLDN18.2阳性胃癌及胃食管交界腺癌时,可显著延长患者的中位总生存期(8.4个月延长到13.2个月);在CLDN18.2表达水平最高的患者中,化疗+ IMAB362组的中位总生存期是16.7个月,而单纯化疗的中位总生存期是9个月,而且在治疗中安全且可耐受。
鉴于IMAB362优异的临床数据,安斯泰来嗅到了商机。其很快以14亿美元的价格收购了Ganymed公司,将IMAB362收入囊中。
在11月中旬公布的III期临床试验中,结果显示,在566例CLDN18.2阳性、HER2阴性的胃癌或胃食管交界处腺癌患者中,研究达到PFS(无进展生存期)主要终点。此外,该研究也达到了的OS(总生存期)关键次要终点。
IMAB362 III期临床试验的成功,为布局CLDN18.2的药企注入了一剂强心针,同时,IMAB362也是进展最快的靶向CLDN18.2的单抗药物,但它并非完 美无缺。IMAB362最大的缺陷在于其对CLDN18.2的亲合力较弱,导致战斗力受限。从以往II期临床数据来看,其疗效受到患者肿瘤细胞CLDN18.2表达比例的影响。
在CLDN18.2表达比例≥70%的患者中,IMAB362+化疗方案的中位PFS为9个月,中位OS为16.5个月,相比于对照组(PFS=5.7个月、OS=8.9个月),具有显著的统计学意义。
在40%≤CLDN18.2≤69%的患者中,IMAB362+化疗方案组中位PFS为4.3个月,中位OS为8.3个月,相比于对照组(中位PFS=4.1个月,中位OS=7.4个月)效果并不明显。
而在上面提到的III期临床试验中,其针对的也只有CLDN18.2表达比例≥75%的高表达患者。因此IMAB362可能会面临覆盖人群受限的问题。毕竟,在胃癌患者群体中,CLDN18.2高表达的患者仅有20%左右。IMAB362的这一缺陷也给后面的玩家带来了成为me-better的机会。
国内玩家谁将率先突围?
CLDN18.2作为极具前景的肿瘤靶向治疗靶点,国内众多创新药企争相布局,成为必争的靶点高地。
国内进展较快的有创胜集团、科济药业、信达生物等。其中创胜集团在CLDN18.2赛道的进度仅次于安斯泰来。其开发的TST001也是全球范围内除IMAB362以外唯一一款进入到II期以后阶段的CLDN18.2单抗。那么与IMAB362相比,谁有可能更胜一筹呢?
从作用机制上看,目前开发靶向CLDN18.2的药物最大的障碍就是选择特异性问题。前面我们已经提到,Claudin 18有Claudin 18.1和CLDN18.2两种亚型。其中Claudin18.1除了在肿瘤细胞上表达外,还在人体正常细胞中表达,且与CLDN18.2相比,仅有8个氨基酸的差异。因此,如果药物选择性不高,很容易与Claudin18.1结合,不仅影响药物疗效,还会带来严重的副作用。
创胜集团的TST001通过独特的表位设计,能够达到仅与CLDN18.2结合的效果。另外,创胜集团降低了TST001的Fc区域的岩藻糖含量,进一步增强了TST001与NK细胞上Fc受体的结合能力。
在TST001联合化疗方案治疗晚期/转移性胃或胃食管连接处腺癌的患者中,I期中期数据显示,对CLDN 18.2中等表达和高表达患者人群均有较好疗效,15例可评估疗效患者的疾病控制率(DCR)高达100%,其中73.3%的患者实现了部分缓解(PR)。而且有1例CLDN 18.2低表达(10%≤表达水平<40%)的患者,经治疗后肿瘤缩小了24.3%,相当于疾病稳定(SD)。此外,在实现PR的11例患者中,有5例为CLDN 18.2表达情况未知的患者。虽然该I期研究中可评估疗效的CLDN 18.2低表达患者例数较少,但也显示出了TST001对CLDN 18.2低表达人群的治疗潜力。
在取得高疗效的同时,TST001安全性优异:治疗中出现的不良事件主要是恶心、呕吐、贫血等,超过80%为轻微的1-2级,无停药事件发生。未来创盛集团还会在低表达患者中展开临床研究。
毫无疑问,TST001未来很有可能覆盖到比IMAB362更大的患者群体,市场份额或将超越IMAB362,也有望成为国内CLDN 18.2率先突围的赛道。
除了TST001外,科济药业的CT-041针对晚期胃癌/食管胃结合部腺癌的研究,已经处于确证性Ⅱ期临床实验阶段。CT-041是科济药业开发的一款靶向CLDN18.2的自体CAR-T产品。在I期临床试验中,37例可评估疗效的患者中有30例(83.3%)患者达到PR,客观缓解率(ORR)为48.6%,DCR为73.0%,mPFS为3.7个月。CT041在治疗CLDN18.2阳性的消化系统肿瘤患者中具有良好耐受性。在CLDN18.2赛道上,CT-041也有成为种子选手的潜力。
另外,信达生物的CLDN18.2/CD3双抗IBI389也是不容忽视的一个选手。IBI389是信达生物自主研发的一款抗CLDN18.2的T细胞衔接双特异性抗体,通过连接T细胞受体复合体中的CD3和肿瘤细胞表面的CLDN18.2抗原,诱导免疫突触形成,刺激T细胞活化,促进细胞溶解蛋白的产生、炎性细胞因子的释放和T细胞进一步增殖,从而达到持续杀伤肿瘤细胞控制肿瘤生长的目的。
临床前结果表明,即使在CLDN18.2低表达的细胞系中,IBI389仍能与肿瘤细胞结合,表现出明显的抗肿瘤效应,有望覆盖常规CLDN18.2抗体治疗无效的中低表达人群。
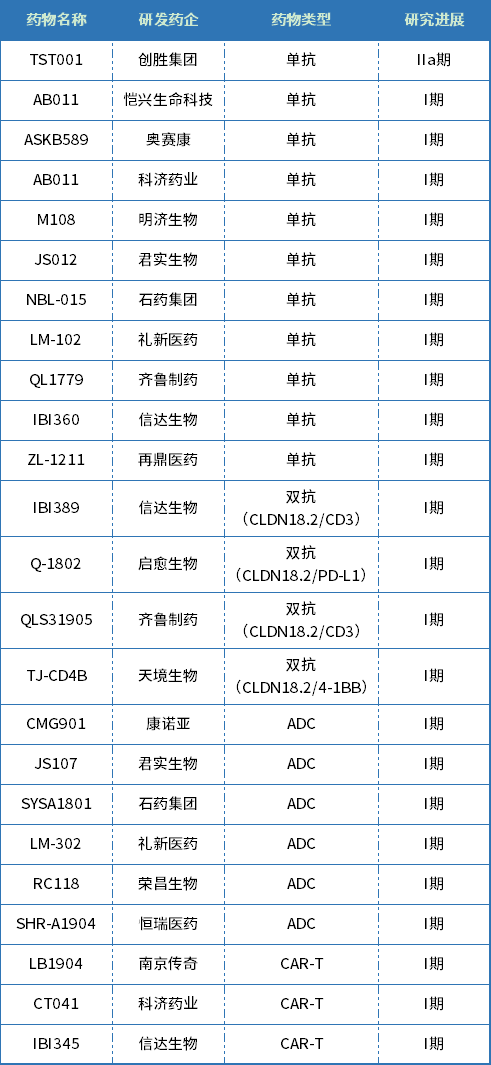
国内进入临床阶段的靶向CLDN18.2的药物(根据公开资料整理)
目前在靶向CLDN18.2的激战中,国内药企进行了诸多尝试,入局的有单抗、双抗、ADC和CAR-T等众多技术路线。虽然现阶段全球尚未有CLDN18.2靶向药物获批上市,但是安斯泰来III期研究的成功已经吹响了CLDN18.2赛道激烈角逐战的号角。未来,赛道竞争一定会越来越火热。
参考:
1.《捷报:安斯泰来Claudin18.2单抗三期临床成功!》,安斯泰来中国,2022-11-24;
2.Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial interim results. Nat Med. 2022 May 9;
3.Evaluation and reflection on claudin 18.2 targeting therapy in advanced gastric cancer. Chin J Cancer Res. 2020 Apr;32(2):263-270;
4.《信达生物宣布Claudin18.2/CD3双特异性抗体药物IBI389完成首例临床患者给药》,信达生物,2022-03-29。
如果这篇文章侵犯了您的权利,请联系我们。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx