来源:国家药监局 编辑:wangxinglai2004
2022年08月29日国家药监局发布了药品抽检质量公告,本次抽检共计涉及9家企业生产的20批次药品,其中值得注意的有2批注射液可见异物不符合规定、3批菊花检出禁用农药残留、7批紫草不符合规定,已对上述药品采取暂停销售使用、召回等风险控制措施。
本次抽检共计7批次紫草不符合规定,涉及2家生产企业桂林中南(亳州)药业科技有限公司(1批)、郑州瑞龙制药股份有限公司(6批);
本次抽检共计3批次茜草不符合规定,涉及2家生产企业桂林中南(亳州)药业科技有限公司(2批)、云南健安堂生物科技有限公司(1批);
盐城市中药饮片有限公司生产的3批次菊花被检出含有禁用农药残留;
四川天府康达药业集团府庆制药有限公司、太极集团四川南充制药有限公司生产的3批次藿香正气水甲醇量超标;
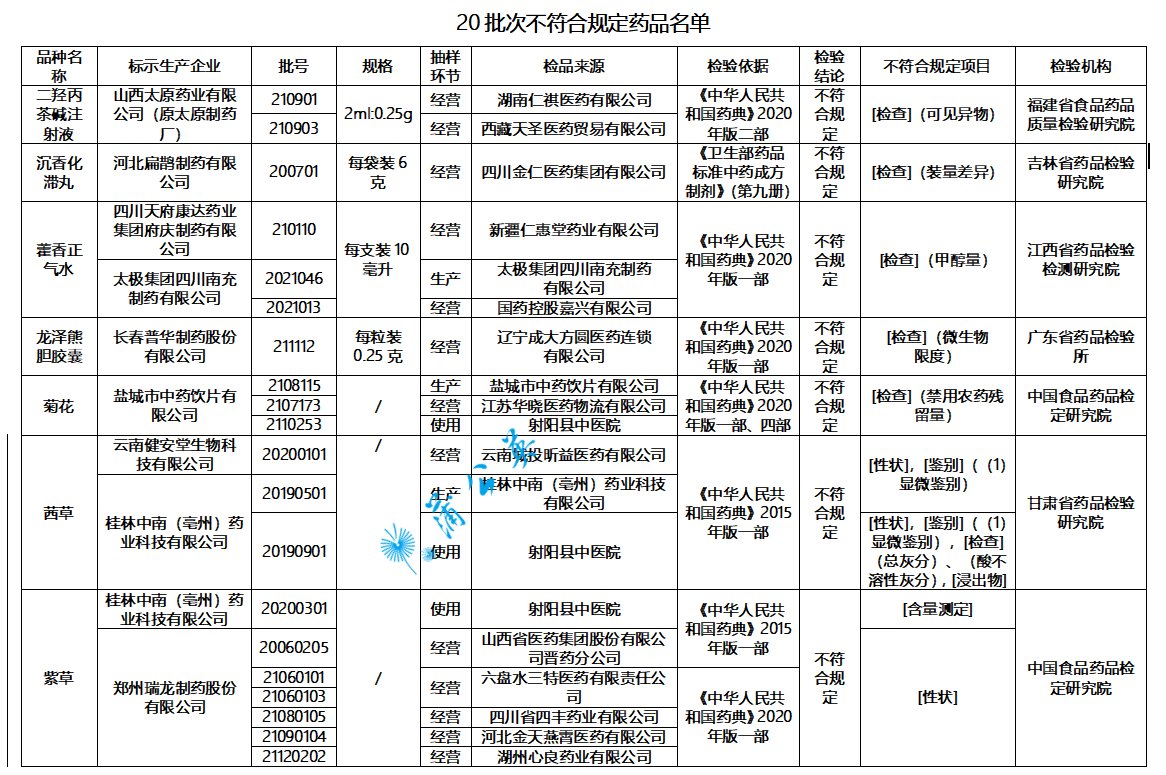
山西太原药业有限公司生产的2批次二羟丙茶碱注射液可见异物不符合规定;
经中国食品药品检定研究院等6家药品检验机构检验,标示为郑州瑞龙制药股份有限公司等9家企业生产的紫草等20批次药品不符合规定。
一、现将相关情况通告如下:
经福建省食品药品质量检验研究院检验,标示为山西太原药业有限公司(原太原制药厂)生产的2批次二羟丙茶碱注射液不符合规定,不符合规定项目为可见异物。
经吉林省药品检验研究院检验,标示为河北扁鹊制药有限公司生产的1批次沉香化滞丸不符合规定,不符合规定项目为装量差异。
经江西省药品检验检测研究院检验,标示为四川天府康达药业集团府庆制药有限公司、太极集团四川南充制药有限公司生产的3批次藿香正气水不符合规定,不符合规定项目为甲醇量。
经广东省药品检验所检验,标示为长春普华制药股份有限公司生产的1批次龙泽熊胆胶囊不符合规定,不符合规定项目为微生物限度。
经中国食品药品检定研究院检验,标示为盐城市中药饮片有限公司生产的3批次菊花不符合规定,不符合规定项目为禁用农药残留量。
经甘肃省药品检验研究院检验,标示为云南健安堂生物科技有限公司生产的1批次茜草不符合规定,不符合规定项目包括性状、鉴别;
经甘肃省药品检验研究院检验,标示为桂林中南(亳州)药业科技有限公司生产的2批次茜草不符合规定,不符合规定项目包括性状、鉴别、总灰分、酸不溶性灰分、浸出物。
经中国食品药品检定研究院检验,标示为桂林中南(亳州)药业科技有限公司生产的1批次紫草不符合规定,不符合规定项目为含量测定;
经中国食品药品检定研究院检验,标示为郑州瑞龙制药股份有限公司生产的6批次紫草不符合规定,不符合规定项目为性状。
二、对上述不符合规定药品,药品监督管理部门已要求相关企业和单位采取暂停销售使用、召回等风险控制措施,对不符合规定原因开展调查并切实进行整改。
三、国家药品监督管理局要求相关省级药品监督管理部门依据《中华人民共和国药品管理法》,组织对上述企业和单位存在的涉嫌违法行为立案调查,并按规定公开查处结果。
特此通告。
扫描二维码查看原文

【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx