来源:药渡撰文:小时光 编辑:丸子近日,再鼎医药宣布efgartigimod的上市申请获国家药监局受理,用于治疗全身型重症肌无力(MG)。这是全球首款且目前唯一获FDA批准上市的FcRn拮抗剂,也是首个获批的通过内源性减少致病性抗体而专门治疗全身型MG的疗法。

图源:https://ir.zailaboratory.com
1
重症肌无力治疗现状
重症肌无力是一种罕见的、慢性自身免疫性疾病,由神经-肌肉接头传递功能障碍引起,病程长、难治愈、易复发,2018年已被纳入我国《第一批罕见病目录》。据统计,全球重症肌无力的年发病率并不高,数值仅为0.3/10万—2.8/10万,但由于重症肌无力是一种慢性病,真实患者群体规模需累加计算,实际上,全球重症肌无力实际患病率大约为10/10万,基于这一数字保守测算,全球重症肌无力患者至少超70万人。国内发病率虽然看似较低,只有0.68/10万,但实际总患者规模大约有20万。并且,未来这一数字可能会持续增长。
如果症状控制不佳,重症肌无力会严重影响患者日常生活和工作,降低活动能力和生活质量,给家庭和社会带来沉重负担。超过85%的成人型重症肌无力患者在发病18个月内会进展为全身型重症肌无力,可不同程度地影响患者的眼球运动、吞咽、言语、活动和呼吸功能,严重者甚至危及生命。
大多数全身性重症肌无力患者有IgG(免疫球蛋白G)自身抗体,其中约有75%-80%乙酰胆碱受体抗体阳性,而阴性的患者中约有30%-40% 肌肉特异性酪氨酸激酶(MUSK)抗体阳性,7-33%的患者低密度脂蛋白受体相关蛋白4(LRP4)抗体阳性。
当前重症肌无力最常见的治疗方案包括乙酰胆碱酯酶抑制剂、免疫抑制剂、靶向生物制剂、静脉注射免疫球蛋白、血浆置换以及胸腺切除等。其中乙酰胆碱酯酶抑制剂是治疗重症肌无力的一线药物,最常用的是溴吡斯的明,不过这类药物只能缓解疾病的症状,不会改变疾病进程。而且通常需要与其他药物(如免疫抑制剂)联合用于治疗重症MG。
免疫抑制药物包括糖皮质激素和其他口服非激素类免疫抑制剂,如硫唑嘌呤、他克莫司、环孢素、甲氨蝶呤、泼尼松及甲泼尼龙等,这类药物副作用巨大,不适合长期服用。
靶向生物制剂方面,在efgartigimod之前,被FDA批准用于治疗MG的有靶向抑制C5补体的依库珠单抗(eculizumab),除此之外,还有适应证外用药的靶向B细胞的利妥昔单抗(rituximab)。不过两者都是针对难治性MG,而且依库珠单抗价格昂贵,容易增加脑膜炎奈瑟菌感染风险,因此适用人群非常有限。
其他挽救性治疗手段如静脉注射免疫球蛋白、血浆置换等,也存在安全性、可及性等问题,
因此,虽然MG治疗方案较多,但仍然存在巨大的未满足需求。
2
Efgartigimod为MG治疗带来新突破
Efgartigimod是由Argenx公司开发的一种针对抗体介导自身免疫疾病的、高度靶向IgG的新型治疗药物。2021年1月,再鼎医药与argenx达成独家授权合作,负责efgartigimod在大中华区的开发和商业化工作,交易总额为1.75亿美元。
Efgartigimod于2021年12月获FDA批准上市,用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力。此后,又于 2022 年 1 月在日本获批,用于治疗对类固醇或非类固醇免疫抑制疗法(ISTs)没有充分应答的全身型重症肌无力成人患者。
值得一提的是,Efgartigimod是全球首款FcRn抑制剂。FcRn(新生儿Fc受体,human neonatal Fc receptor)是一种位于细胞膜表面的IgG抗体受体,主要在内皮细胞中表达。FcRn可以和IgG的Fc段结合,阻止IgG分子被溶酶体裂解,可以起到增长IgG体内半衰期的作用,参与到IgG的体内转运、维持和分布代谢过程中。Efgartigimod能与FcRn高亲和力结合,阻断IgG的内循环,减少致病性IgG抗体的水平,从而治疗由致病性IgG抗体介导的自身免疫性疾病,包括重症肌无力、慢性炎症性脱髓鞘性多发性神经病(CIDP)和天疱疮(PV)等疾病。
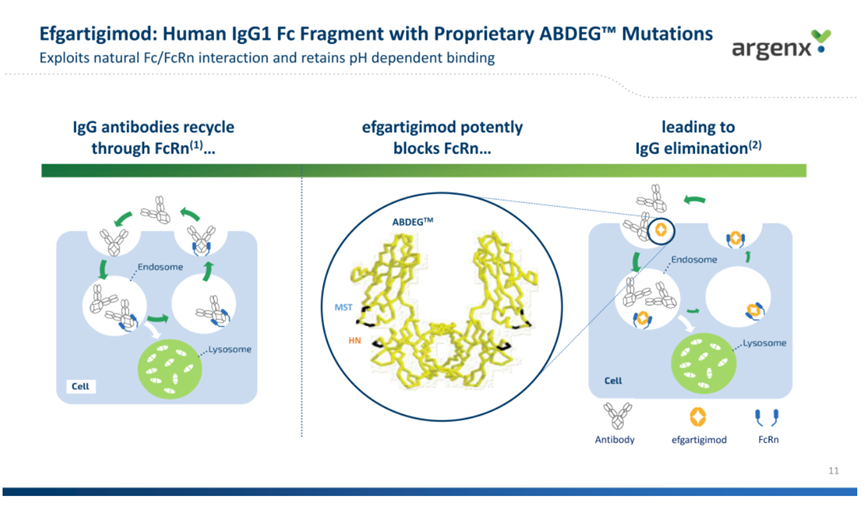
Efgartigimod工作原理(来源:Argenx公司官网)
在efgartigimod 的关键性 III 期 ADAPT 临床研究中,共入组167例成人MG患者,并以1:1 的比例随机分配接受efgartigimod或安慰剂,共治疗26周。结果显示达到主要研究终点:在AChR阳性的MG患者中,根据重症肌无力日常生活活动(MG-ADL)评分,与安慰剂组相比,efgartigimod 治疗组有更高比例的患者为应答者(67.7% vs 29.7%;p<0.0001)。(应答者被定义为在 MG-ADL 评分上至少有 2 分的改善,且连续 4 周或更长时间)
安全性方面,efgartigimod治疗组与安慰剂组相当。最常见的不良反应是呼吸道感染(33%对比29%安慰剂)、头痛(32%对比29%安慰剂)和尿路感染(10%对比5%安慰剂)。
另外,在重症肌无力的治疗中,
相较于现有治疗方案,efgartigimod具有起效快、疗效相对持久、安全性优等特点,尤其是对于难治型患者和可能发展为危象的MG患者具有显著优势。 3
FcRn抑制剂国内布局概况
由于阻断FcRn可以选择性的清除血清中的IgG抗体,加快自体免疫抗体在体内的清除,达到治疗自身免疫疾病的目的。因此,
FcRn成为自免领域的又一潜在重磅靶点。据不完全统计,目前全球已有10款FcRn抑制剂在研, 在国内,进入III期临床阶段的有强生的nipocalimab、优时比的 rozanolixizumab 以及和铂医药/HanAll Biopharma的巴托利单抗(HBM9161/batoclimab )三款药物。
1强生——nipocalimab
Nipocalimab是Momenta公司开发的一款去糖基化的全人源IgG1抗体,靶向FcRn,曾被FDA授予预防胎儿和新生儿溶血病以及治疗重症肌无力的孤儿药资格。2020 年 8 月,强生以约 65 亿美元收购Momenta,由此获得了Nipocalimab。
目前Nipocalimab治疗重症肌无力的II期临床试验已取得积极结果:所有4个nipocalimab治疗组均显示出MG-ADL量表评分改善。在国内,Nipocalimab于 2021 年 8 月首次获批临床,当前正在开展一项针对重症肌无力的 III 期国际多中心临床试验。
2优时比——rozanolixizumab
Rozanolixizumab 是一款皮下注射FcRn靶向单抗,以高亲和力特异性结合人类FcRn,通过阻断FcRn和IgG的相互作用,以加速IgG的分解代谢。
2021年12月,优时比宣布了评估rozanolixizumab与安慰剂治疗MG成人患者的III期研究MycarinG的结果:治疗第43天,与安慰剂组相比,Rozanolixizumab治疗组患者MG-ADL总评分相对基线发生了具有统计学意义和临床意义的变化,达到主要终点。此外,该研究的全部次要终点也达到了统计学意义。安全性方面,Rozanolixizumab耐受性良好,未发现新的安全信号。
在国内,2020年7月,Rozanolixizumab首次获批临床,用于MG的治疗。目前正在开展一项针对原发性免疫性血小板减少症治疗的III期临床研究。
3和铂医药/HanAll Biopharma——巴托利单抗
巴托利单抗是一种全人源单克隆抗体,可阻断FcRn-IgG相互结合,加速体内IgG的清除,从而达到有效治疗致病性IgG介导的自身免疫性疾病的效果。在重症肌无力的II期研究中,巴托利单抗可快速、显著地缓解临床症状,改善患者的生活质量。早期研究表明巴托利单抗具有良好耐受性,可迅速降低多种自身免疫疾病患者体内IgG水平。巴托利单抗是和铂医药从HanAll Biopharma引进的全球创新药,和铂医药拥有在大中华地区(包括香港、澳门和台湾)进行开发、制造和商业化的权利。在国内,巴托利单抗已被CDE纳入突破性治疗品种,目前正在开展针对MG的III期临床试验。
临床需求决定药物价值。随着重症肌无力创新药物上市,市场需求持续攀升,预计未来市场规模爆发式增长。根据GlobeNewswire的报道,在2021年全球重症肌无力治疗药物市场规模为13.7亿美元,预计到2025年达到30.5亿美元。中国重症肌无力药物市场规模也呈现快速增长趋势,在2021年达到0.45亿美元,预计到2025年达到2.5亿美元。而此次efgartigimod在国内获批上市,对国内20万MG患者来说,也是一个全新时代的开始。
参考:
1.https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-myasthenia-gravis;
2.https://www.argenx.com/news/argenx-announces-us-food-and-drug-administration-fda-approval-vyvgarttm-efgartigimod-alfa-fcab;
3.FDA Approves Soliris® (Eculizumab) for the Treatment of Patients with Generalized Myasthenia Gravis (gMG). Retrieved Oct 23, 2017, from https://www.businesswire.com/news/home/20171023006539/en/FDA-Approves-Soliris%C2%AE-Eculizumab-for-the-Treatment-of-Patients-with-Generalized-Myasthenia-Gravis-gMG;
4.https://www.globenewswire.com/news-release/2021/04/07/2205763/28124/en/Global-Myasthenia-Gravis-Drugs-Industry-2020-to-2027-Market-Trajectory-Analytics.html.
 图源:https://ir.zailaboratory.com
图源:https://ir.zailaboratory.com Efgartigimod工作原理(来源:Argenx公司官网)
Efgartigimod工作原理(来源:Argenx公司官网)