导言
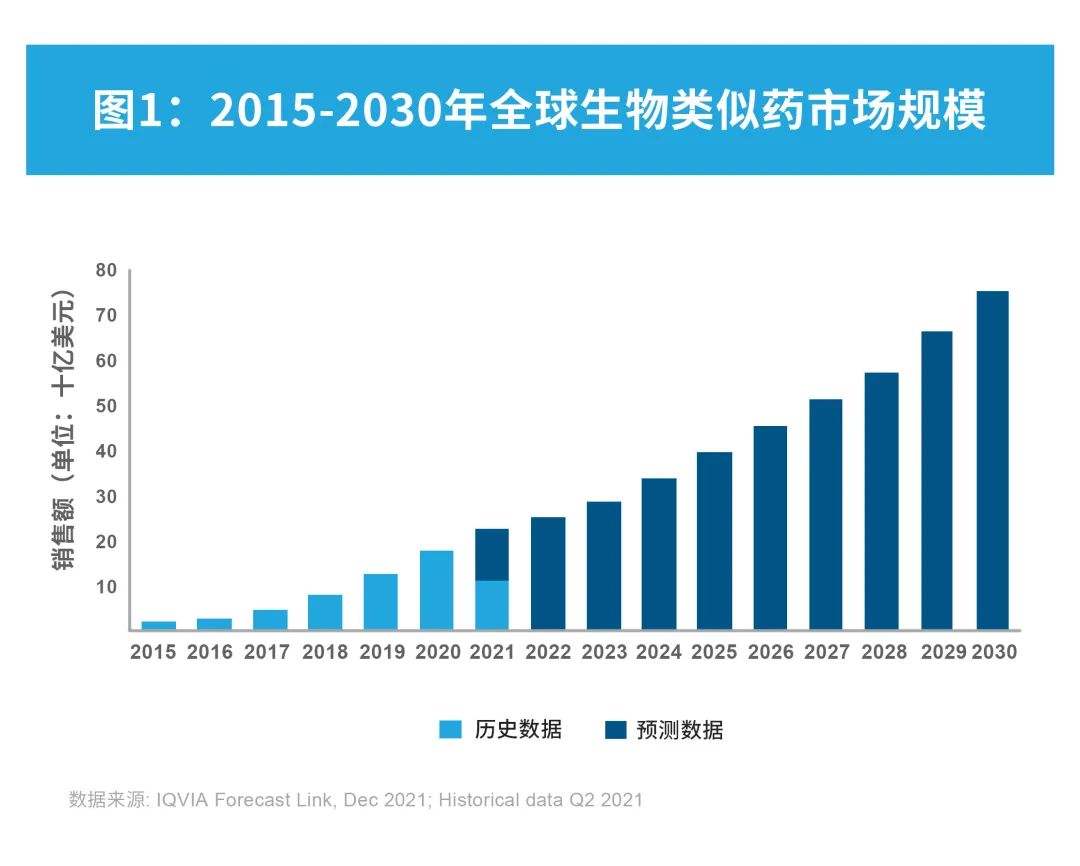
全球范围内,生物类似药的使用量正在迅速增长,并在未来十年保持上升趋势。根据IQVIA Forecast Link统计,2015年至2020年间,生物类似药市场以年复合增长率7.8%的增速持续上升,于2020年达到约179亿美元。据预计,2020至2030年间,生物类似药市场将以15%的年复合增长率快速发展,2030年将达到750亿美元。
本文将分析预测生物类似药市场未来发展趋势以及不同区域和产品类型之间使用量差异。此外,本文还将简要探讨该预期增长背后主要的推动因素。
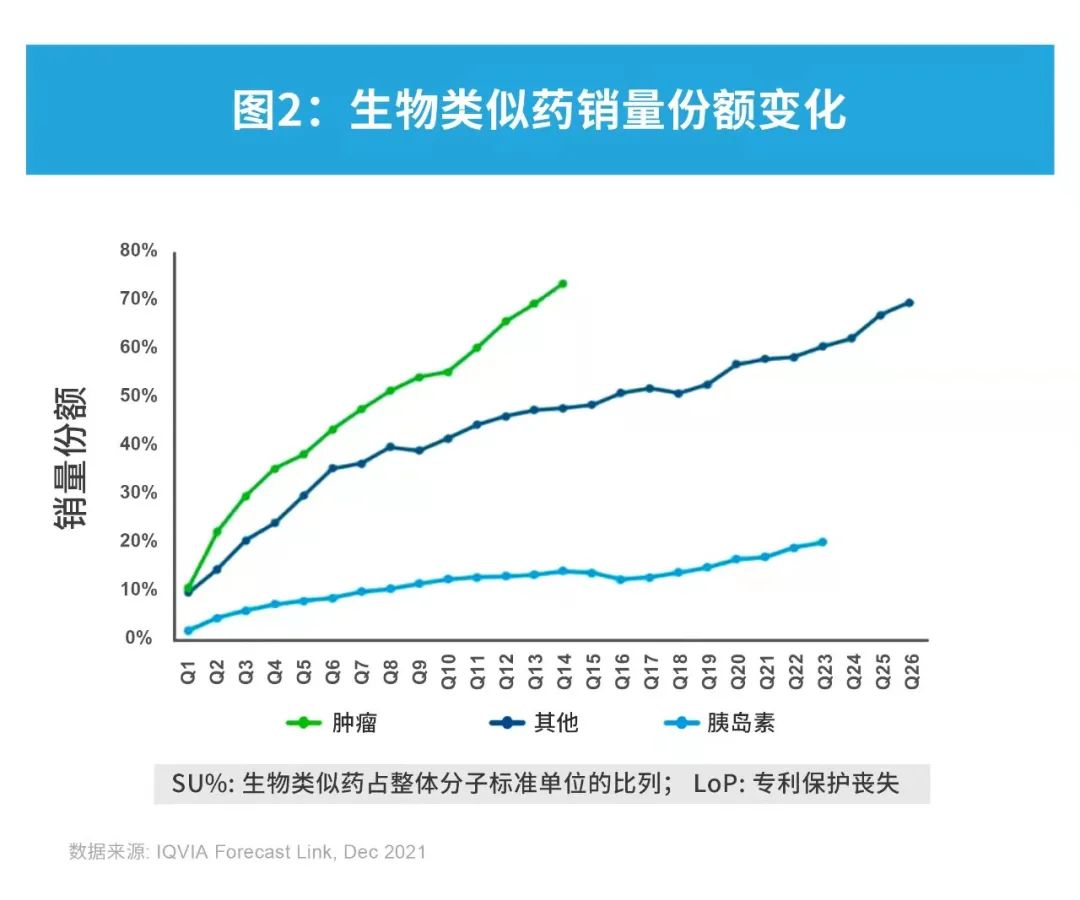
近年来,不同区域上市、不同分子的生物类似药销量份额变化趋势有所不同。在全球范围内,用于治疗糖尿病的胰岛素类似物(如甘精胰岛素和赖脯胰岛素)的使用量变化趋势较为平缓,而贝伐珠单抗(bevacizumab)、利妥昔单抗(rituximab)和曲妥珠单抗(trastuzumab)等肿瘤领域生物类似药的用量快速攀升。平均来说,针对其他适应症的分子,如阿达木单抗(adalimumab)、英夫利昔单抗(infliximab)和特立帕肽(teriparatide)的销量份额上升趋势介于胰岛素类似物与肿瘤生物类似药之间。
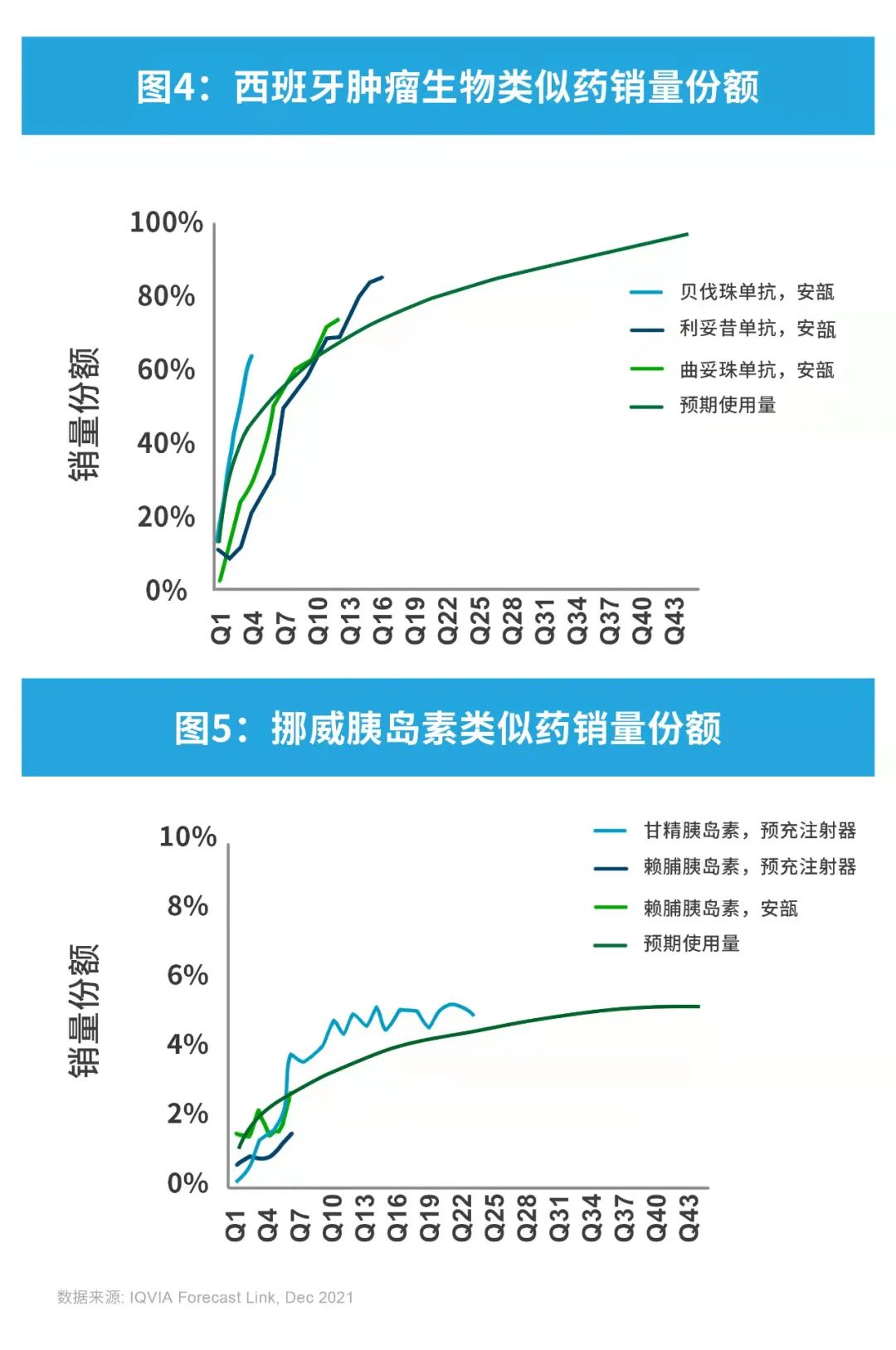
但国家层面上存在例外,原因主要有医生和患者的接受程度、政策鼓励力度、价格差异,以及国家采用单方还是多方参与的招投标系统。就胰岛素而言,出于对安全性和疗效的考量,医生和患者使用生物类似药的意愿不高。然而,在欧洲,欧洲药品管理局(EMA)让欧洲各国自行决定生物类似药是否具备互换性和替代性。由于用于治疗肿瘤的生物制品价格过高,对此,一些国家已推出相关政策,增加生物类似药的使用量。例如,西班牙和波兰规定:生物类似药的定价必须在原药价格基础上分别降价至少25%和40%;挪威大多数医院已签订肿瘤生物类似药的使用合同,推动生物类似药的使用。
未来十年里,生物类似药市场发展的关键驱动因素在于同期专利到期的原研产品数量。产品专利到期作为IQVIA Forecast Link考量的一个预测假设事件,其时间主要由关键专利到期决定,但同时考虑了在研生物类似药研发进展的证据。2021-2030年期间,大量原研产品面临专利保护到期,这些产品2020年的全球销量合计约达1440亿美元。
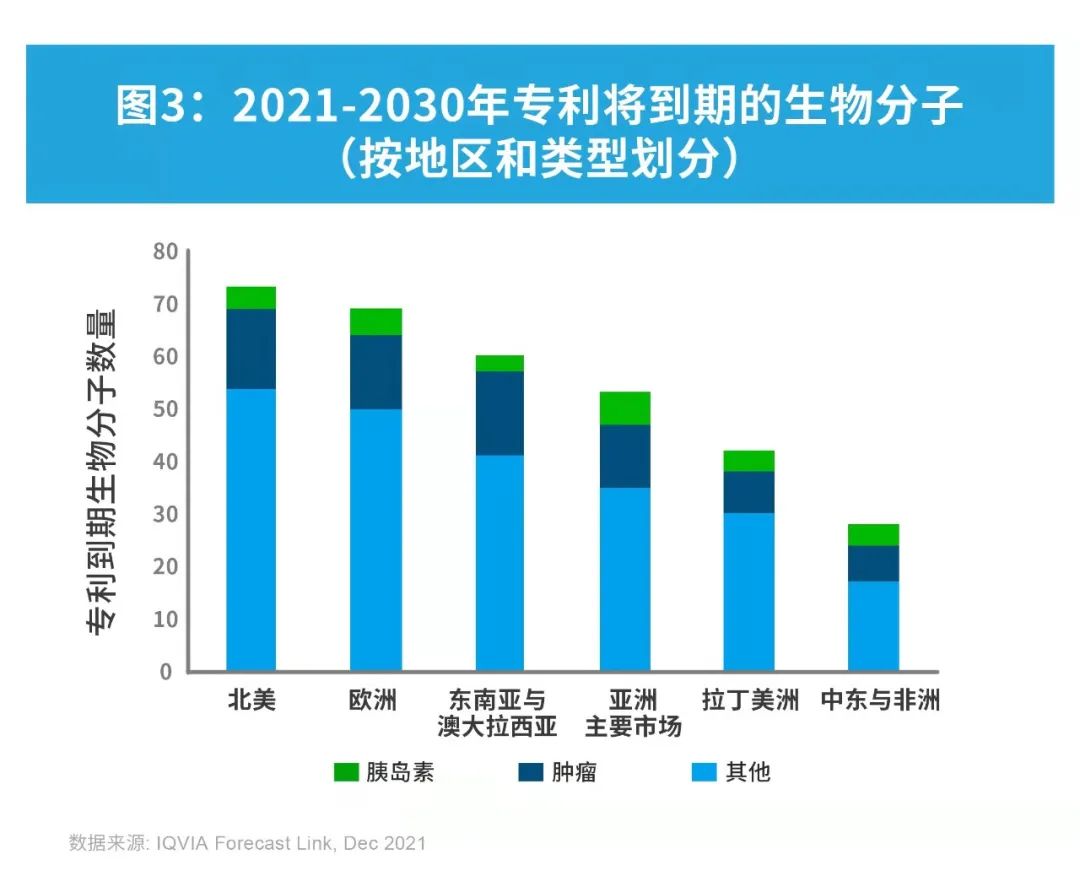
IQVIA Forecast Link回顾了生物类似药在国家层面的历史使用情况,并基于历史趋势和专家预测,就未来生物类似药(按肿瘤、胰岛素和其他分子划分)使用情况进行展望。若该国没有可类比历史数据,IQVIA Forecast Link则采用地区平均值作为参考。上述数据将被用于预测未来专利到期的原研生物制品及其生物类似药之间的销量份额变化。基于2021年第二季度数据调整的预测趋势如下图所示。
从区域层面来看,尽管未来十年亚洲主要市场、拉丁美洲和东南亚以及澳大拉西亚的生物类似药用量(以患者天数PATDAY计)年复合增长率更高,预计2030年欧洲与北美仍将占据生物类似药市场的大部分市场份额。
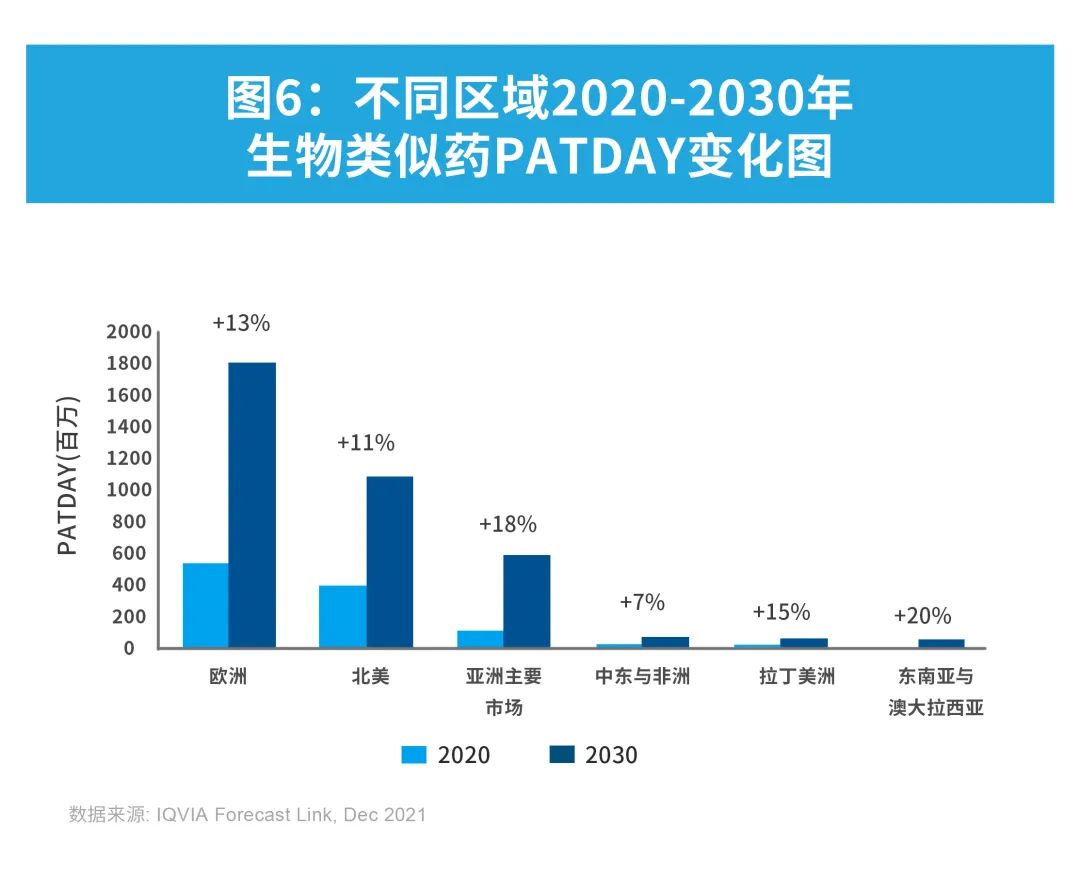
尽管生物类似药的使用情况因分子和区域的不同而存在较大差异,但可以肯定的是,生物类似药的市场规模在未来十年内将大幅增长。未来,大量药品专利到期与更大幅度的医疗开支下调,是驱动生物类似药市场持续增长的重要因素。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx