2022年03月31日,国家药监局官网发布再次公开征求《药品上市许可持有人检查要点(征求意见稿)》意见,征求意见截止日期2022年4月30日。这是国内专门针对药品上市许可持有人检查指南,这是国家药监局为贯彻实施《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》,全面落实药品上市许可持有人对药品研制、生产、经营、使用全过程中药品的安全性、有效性和质量可控性的主体责任,进一步规范对药品上市许可持有人的监督检查工作。该检查指南弥补了我国对MAH现场检查在法规层面和技术层面的空白,进一步完善MAH监管长效机制。本文对《药品上市许可持有人检查要点(征求意见稿)》中主要内容进行了分析,建议药品上市许可持有人开始对照检查吧,如有补充欢迎文末留言分享。
一、MAH制度历史沿革及相关法规概述
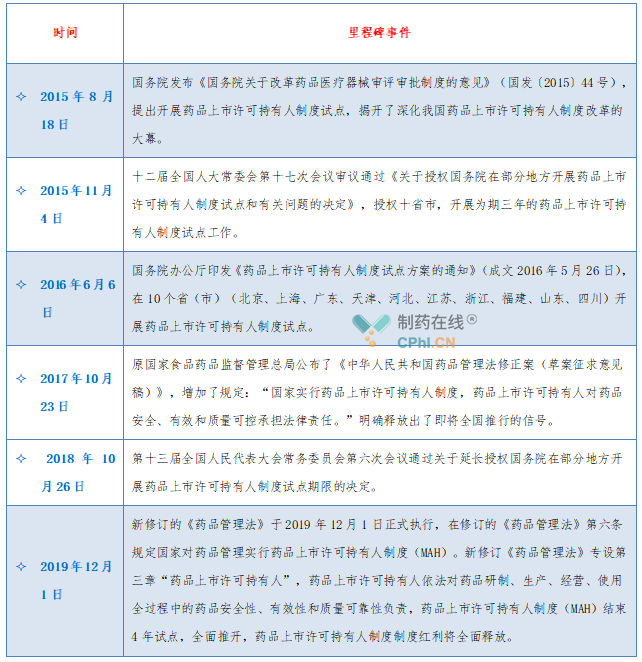
我国药品上市许可持有人制度是一个从无到有、不断完善、循序渐进的过程,新版《药品管理法》实施后,标志着药品上市许可持有人制度全面落地实施,各阶段政策法规摘录见下表:
二、MAH制度文件化
持有人应当建立覆盖药品研制、生产、销售、使用全过程的质量保证体系,持续强化的质量控制和质量保证能力,依法对药品研制、生产、销售、使用全过程的安全性、有效性、质量可控性负责,人员是关键,硬件是基础,软件是保证,从目前的实际情况来看,我国许多MAH在硬件建设方面普遍投入充足,人员素质也相对比较高,但软件系统的完善是当前进行质量保证体系的首要任务,《药品上市许可持有人检查要点(征求意见稿)》对于文件体系有了更具体的要求:持有人应当建立保证药品全生命周期主体责任的规章制度。委托其他企业进行药品生产、销售相关活动(包括药品储存、运输)的,相关制度应当与受托企业的质量管理体系文件有效衔接,并按照规定形成相关记录或报告。包括但不限于:
(1)药品生产场地管理文件;
(2)委托协议和质量协议;
(3)持有人对受托企业的审核程序、现场审核报告及记录;
(4)研制、生产、销售监督管理程序与记录。
(5)药品质量回顾分析制度及药品质量回顾分析报告;
(6)药品生产工艺规程、空白批生产记录、质量标准及检测程序;
(7)受托生产企业共线生产药品列表及风险评估报告(或关于避免污染及交叉污染的相关程序与记录/报告);
(8)药品偏差、变更控制、自检、不合格品处理、纠正与预防措施、质量投诉、退货、召回、物料与产品、确认与验证、稳定性试验、数据可靠性、培训、员工健康、上市放行、追溯等管理程序及记录;
(9)生产关键物料合格供应商名单;
(10)质量信息沟通及处置的规定与沟通记录;
(11)药品安全事件处置方案与培训、演练记录;
(12)药物警戒管理程序与记录;
(13)药品年度报告管理程序与记录;
(14)药品上市后风险管理计划与记录;
(15)短缺药品停产报告管理程序与记录(针对短缺药品的持有人)。
建立一套文件系统成功与否,关键是文件总目录的确定,先拟定文件目录草案,这样可以进行文件编制分工,明确目标、掌握进度,在编制过程中可以结合公司实际情况对文件目录进行修改,文件目录至少涵盖岗位职责类文件、技术标准类文件、管理标准类文件、操作标准类文件、记录类文件等文件目录。MAH文件体系包括的制度清单建议如下:
| 类别 | 名称 |
| 岗位职责类文件 | 企业负责人岗位职责 |
| 岗位职责类文件 | 生产管理负责人岗位职责 |
| 岗位职责类文件 | 质量管理负责人岗位职责 |
| 岗位职责类文件 | 质量受权人岗位职责 |
| 岗位职责类文件 | 药物警戒负责人岗位职责 |
| 岗位职责类文件 | 相关部门职能 |
| 岗位职责类文件 | 相关岗位职责 |
| 技术标准类文件 | 产品相关工艺验证方案 |
| 技术标准类文件 | 产品相关工艺规程 |
| 技术标准类文件 | 产品相关质量标准 |
| 操作标准类文件 | 药品安全事件处置标准操作规程 |
| 操作标准类文件 | 产品不良反应监测与管理操作规程 |
| 操作标准类文件 | 个例药品不良反应处理操作规程 |
| 操作标准类文件 | 药品群体不良反应时间处理操作规程 |
| 操作标准类文件 | 药品定期安全性更新报告操作规程 |
| 操作标准类文件 | 药品重点检测操作规程 |
| 操作标准类文件 | 药品安全性信号监测评价与控制操作规程 |
| 操作标准类文件 | 文献检索操作规程 |
| 操作标准类文件 | 药品监管机构提出问题回复操作规程 |
| 操作标准类文件 | 药品说明书更新程序操作规程 |
| 操作标准类文件 | 不良反应数据处理操作规程 |
| 操作标准类文件 | 药物警戒体系内审操作规程 |
| 操作标准类文件 | 药物警戒信息化系统验证与测试操作规程 |
| 操作标准类文件 | 药物警戒个例药品不良反应报告和处理操作规程 |
| 操作标准类文件 | 药物警戒药品聚集性事件报告和处理操作规程 |
| 操作标准类文件 | 药物警戒境外发生的严重不良反应报告和处理操作规程 |
| 操作标准类文件 | 药物警戒文献检索操作规程 |
| 操作标准类文件 | 药物警戒数据处理操作规程 |
| 操作标准类文件 | 药物警戒风险管理计划操作规程 |
| 操作标准类文件 | 上市后安全性研究操作规程 |
| 操作标准类文件 | 定期安全性更新报告操作规程 |
| 操作标准类文件 | 处理医学咨询和投诉操作规程 |
| 操作标准类文件 | 产品相关检验操作规程 |
| 管理标准类文件 | 委托生产企业的审核及管理规程 |
| 管理标准类文件 | 工艺规程的编制与管理规程 |
| 管理标准类文件 | 药品上市放行管理规程 |
| 管理标准类文件 | 产品投诉与不良反应监测管理规程 |
| 管理标准类文件 | 产品储存、发运、退货、召回管理规程 |
| 管理标准类文件 | 质量管理自检管理规程 |
| 管理标准类文件 | 物料供应商管理规程 |
| 管理标准类文件 | 物料与产品放行管理规程 |
| 管理标准类文件 | 质量事故管理规程 |
| 管理标准类文件 | 质量信息沟通及处置管理规程 |
| 管理标准类文件 | 药品售后服务与责任赔偿管理规程 |
| 管理标准类文件 | 药品警戒管理规程 |
| 管理标准类文件 | 药品追溯管理规程 |
| 管理标准类文件 | 药品上市后风险管理规程 |
| 管理标准类文件 | 药品上市后评价管理规程 |
| 管理标准类文件 | 短缺药品停产、退市报告管理规程 |
| 管理标准类文件 | 公司质量方针和质量目标管理规程 |
| 管理标准类文件 | 药品再注册管理规程 |
| 管理标准类文件 | 质量管理体系文件管理规程 |
| 管理标准类文件 | 质量管理体系文件分类、编号与格式管理规程 |
| 管理标准类文件 | 产品质量档案管理规程 |
| 管理标准类文件 | 记录管理规程 |
| 管理标准类文件 | 产品质量回顾管理规程 |
| 管理标准类文件 | 变更控制管理规程 |
| 管理标准类文件 | 不合格品管理规程 |
| 管理标准类文件 | 纠正与预防措施(CAPA)管理规程 |
| 管理标准类文件 | 质量风险管理规程 |
| 管理标准类文件 | 偏差管理规程 |
| 管理标准类文件 | 药品年度报告管理规程 |
| 管理标准类文件 | 生产计划和调度管理规程 |
| 管理标准类文件 | 返工管理规程 |
| 管理标准类文件 | 产品回收管理规程 |
| 管理标准类文件 | 印刷性包材管理规程 |
| 管理标准类文件 | 组织机构及定岗、定编、岗位职责管理规程 |
| 管理标准类文件 | 药品安全委员会管理规程 |
| 管理标准类文件 | 质量培训及考核管理规程 |
| 管理标准类文件 | 员工卫生和健康管理规程 |
| 管理标准类文件 | 药物警戒主文件 |
| 管理标准类文件 | 药物警戒体系管理规程 |
| 管理标准类文件 | 药品不良反应报告和监测 |
| 管理标准类文件 | 临床试验期间药物警戒管理规程 |
| 管理标准类文件 | 药物警戒委托工作管理规程 |
| 管理标准类文件 | 药物警戒信息化系统管理规程 |
| 管理标准类文件 | 药物警戒信号检测管理规程 |
| 管理标准类文件 | 药物警戒风险管理规程 |
| 管理标准类文件 | 药物警戒数据库管理规程 |
| 管理标准类文件 | 药物警戒风险信号管理规程 |
| 管理标准类文件 | 组织机构图管理规程 |
| 管理标准类文件 | 产品批号、生产日期、有效期的编制及管理规程 |
| 管理标准类文件 | 说明书、标签管理规程 |
| 管理标准类文件 | 物料与产品管理规程 |
| 管理标准类文件 | 药品运输管理规程 |
| 管理标准类文件 | 防污染及交叉污染管理规程 |
| 管理标准类文件 | 药品储存管理规程 |
| 管理标准类文件 | 委托检验管理规程 |
| 管理标准类文件 | 检验方法转移或确认管理规程 |
| 管理标准类文件 | 留样管理规程 |
| 管理标准类文件 | 稳定性考察管理规程 |
| 管理标准类文件 | 药品生产场地管理文件 |
| 管理标准类文件 | 确认与验证管理规程 |
| 管理标准类文件 | 数据管理规程 |
| 管理标准类文件 | 研制监督管理规程 |
| 管理标准类文件 | 生产监督管理规程 |
| 管理标准类文件 | 销售监督管理规程 |
| 记录类文件 | 管理标准/操作标准/技术标准等相关记录 |
参考文献
[1]www.nmpa.gov.cn
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx