近日,罗氏抗体偶联药物(ADC)注射用恩美曲妥珠单抗在国内的第二个上市申请(相关受理号为JXSS2000016/17)在NMPA的状态变更为“在审批”,预计不日将获批新适应症。
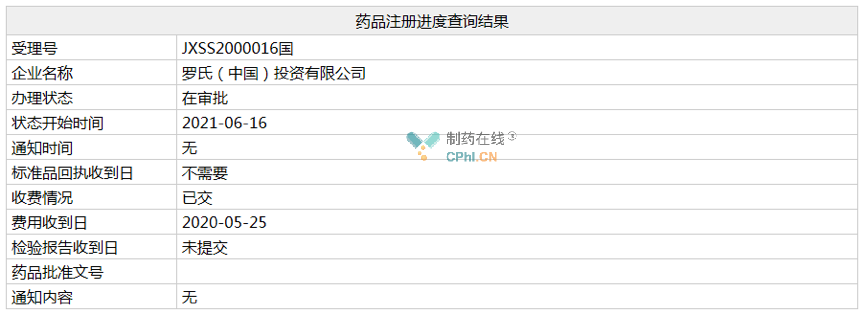
恩美曲妥珠单抗(ado-trastuzumab emtansine,Kadcyla)是罗氏和ImmunoGen共同开发的一款抗体偶联药物(ADC),由HER2靶向的曲妥珠单抗、抑制微管聚集化疗药物美坦新(DM1)通过硫醚连接子MCC连接而成。2013年2月,该药在美国获批,截止目前获批的适应症包括:1)单药治疗接受过曲妥珠单抗和/或紫杉醇的晚期转移性HER2+乳腺癌(2013/02);2)单药用于新辅助治疗(紫杉烷类联合曲妥珠单抗)后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗(2019/05)。
截至目前,Kadcyla已在全球100多个国家获批上市。作为首 个获批单药治疗既往已接受曲妥珠单抗和紫杉烷化疗(单独或联合治疗)的HER2阳性转移性乳腺癌的ADC,Kadcyla上市后销售额逐年攀升,2020年高达17.45亿瑞士法郎(约18.6亿美元)。
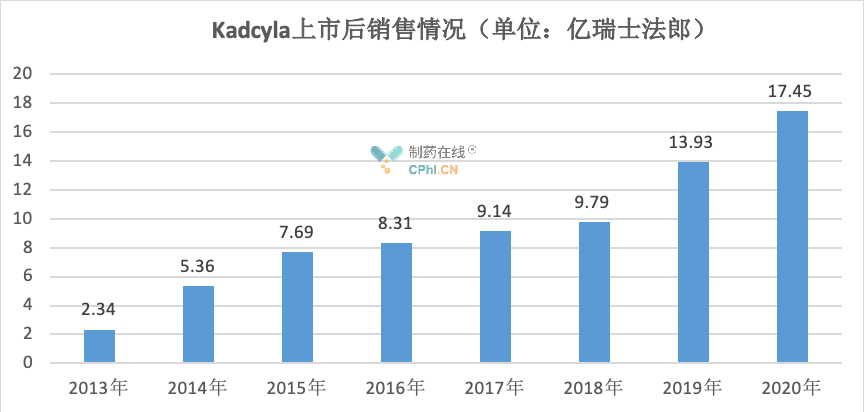
在国内,恩美曲妥珠单抗通过优先审评方式于今年1月在国内获批,适应症为单药用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗,商品名为赫赛莱。作为国内获批的首 个ADC,据米内网数据,赫赛莱在我国城市实体药店2020年销售额达1.84亿美元。未来随着新适应症的获批,赫赛莱的销售额有望再上新高。
目前,2021年新一轮医保目录调整工作的开始,期待赫赛莱可以进入国家医保,惠及更多患者。此外,值得一提的是,目前国内已有企业开始布局恩美曲妥珠单抗生物类似物市场,如上海医药、海正药业、恒瑞医药和三生国健。
国内ADC药物集齐3款,2款进口,1款国产
抗体偶联药物(ADC)是一类由抗体、连接子和细胞毒性药物组成的靶向生物制剂,兼具单克隆抗体的靶向能力、高选择性、稳定性与负载药物的高效抗癌潜力,能够精准区分正常细胞和肿瘤细胞,将细胞毒性药物靶向递送至肿瘤细胞内,具有极高的杀伤能力。
近年来,ADC药物已成为医药领域的热门研发赛道。自2000年首 款ADC获批以来,截止目前全球已经批准13款ADC,详见下表。
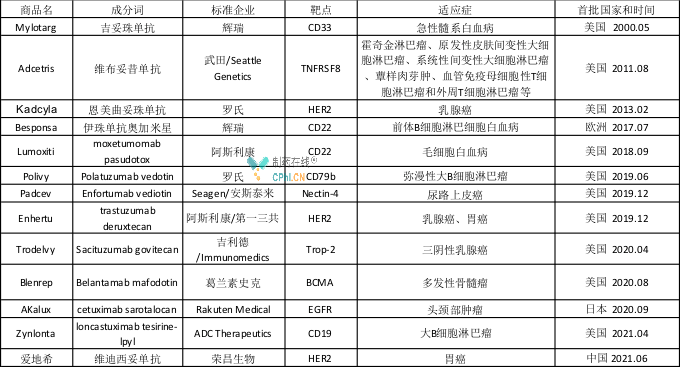
然而,目前国内获批的ADC仅3款,即罗氏的恩美曲妥珠单抗、武田的维布妥昔单抗和荣昌生物的维布妥昔单抗。其中维布妥昔单抗是一款CD30靶向的ADC,由靶向CD30蛋白的单克隆抗体和微管破坏剂通过蛋白酶敏感的交联剂偶联而成,2020年5月在国内获批,商品名为安适利。目前,安适利已在国内获批两个适应症,即CD30阳性的复发性/难治性经典型霍奇金淋巴瘤(cHL)和系统性间变性大细胞淋巴瘤(sALCL),以及CD30阳性的既往接受过系统性治疗的成人原发性皮肤间变性大细胞淋巴瘤(pcALCL)和蕈样真菌病(MF)。纬迪西妥单抗试国内获批的首 款国产ADC,由人源化HER2抗体和毒素载荷一甲基澳瑞他汀E(MMAE)通过可被组织蛋白酶剪切的连接子彼此偶连而成,2021年6月被NMPA批准用于治疗复发/转移后至少接受过2个系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部癌)患者。
版权所有,未经允许,不得转载。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx