4 月份,美国食品药品监督管理局( FDA)对 6 项已经加速批准、但验证性研究失败的 PD-1/PD-L1 抑制剂适应证进行讨论,以决定这些适应证的去留。
最终,专家投票结果为阿替利珠单抗的三阴性乳腺癌(TNBC)一线治疗、尿路上皮癌(UC)一线治疗、帕博利珠单抗尿路上皮癌一线治疗、肝细胞癌(HCC)二线治疗适应证被支持保留,而帕博利珠单抗三线治疗胃癌和纳武利尤单抗二线治疗肝细胞癌的适应证被建议撤销。
这一系列操作并非轻率,而是按照指南进行。关于抗肿瘤药物传统批准和加速批准的临床研究终点,FDA 最早在 2007 年出台了指南,之后又在 2018 年进行更新 [1]。指南认识到科学的发展可促进抗肿瘤药物的研发,因此鼓励探索额外终点来促进药物获批。今天笔者就把相关规定和近来的发展进行梳理。
传统批准和加速批准
传统批准适应证是指基于可以证实临床获益的终点,或已经证实可以预测临床获益的替代终点效应而获批的途径。加速审批是指基于可能可合理预测临床获益的替代终点或过渡终点而批准药物适应证的途径。
加速批准的规章发表于 1992 年。规章规定在治疗严重或威胁生命疾病时,FDA 可以基于合理的可能预测临床获益的替代终点来批准药物。这些替代终点对临床获益的预测确定性通常不如传统终点。FDA 也可以基于比不可逆并发症或死亡更早发生、并可合理预测这些事件的临床终点(如过渡临床终点)而加速批准药物。
加速获批时通常需要证实药物优于可行治疗或当前没有可行疗法,而传统获批只需要展示药物具有直接临床获益,不要求优于现有治疗。此外,加速获批要求上市后确认性研究来证实临床获益,如果不能证实,FDA 可以撤回药物适应证。
肿瘤获批终点的发展历程
20 世纪 70 年代,FDA 常根据客观反应率(Objective Response Rate, ORR)批准药物。到了 80 年代,经过肿瘤药物咨询委员会(Oncologic Drugs Advisory Committee, ODAC)讨论,FDA 确定癌症药物获批应基于临床获益更为直接的证据,例如生存的改善是最为合理的临床获益指标,此外还包括患者生活质量(Quality of Life, QoL)的改善,或肿瘤相关症状的改善。这些获益通常和 ORR 相关性较差。
无病生存期(Disease Free Survival, DFS)的改善可支持辅助治疗批准,因为很多患者复发时会产生症状。持续的完全缓解(Complete Remission, CR)支持白血病治疗的传统批准,因为 CR 和更少的感染、出血和血制品使用相关。无进展生存期(Progression Free Survival, PFS)的改善或高度显著持续的 ORR 支持某些肿瘤的传统批准,但是决策时也应考虑改善的强度,肿瘤相关症状的缓解和药物毒性,例如 ROS1 阳性转移性非小细胞肺癌使用 ORR 支持传统批准。
持续的 ORR 可以在某些情况下用作传统获批终点,而 ORR 也是最常用的加速审批替代终点。ORR 可以直接反映药物作用,没有可行治疗的难治肿瘤的单臂研究就可以准确评估 ORR。ORR 和 PFS 是作为传统还是加速批准依赖于疾病和疗效强度。
常用的临床研究终点
同一终点到底是作为传统终点支持传统获批,作为替代终点支持传统获批,还是作为替代终点支持加速获批,取决于疾病,临床效应的大小,效应持续时间,反应深度(CR 比例),现有治疗,和风险获益关系等。目前常用终点包括基于肿瘤评估的生存终点,症状评估终点,血液或体液为基础的生物标志物,和一些新型终点。
1. 生存终点和症状评估终点
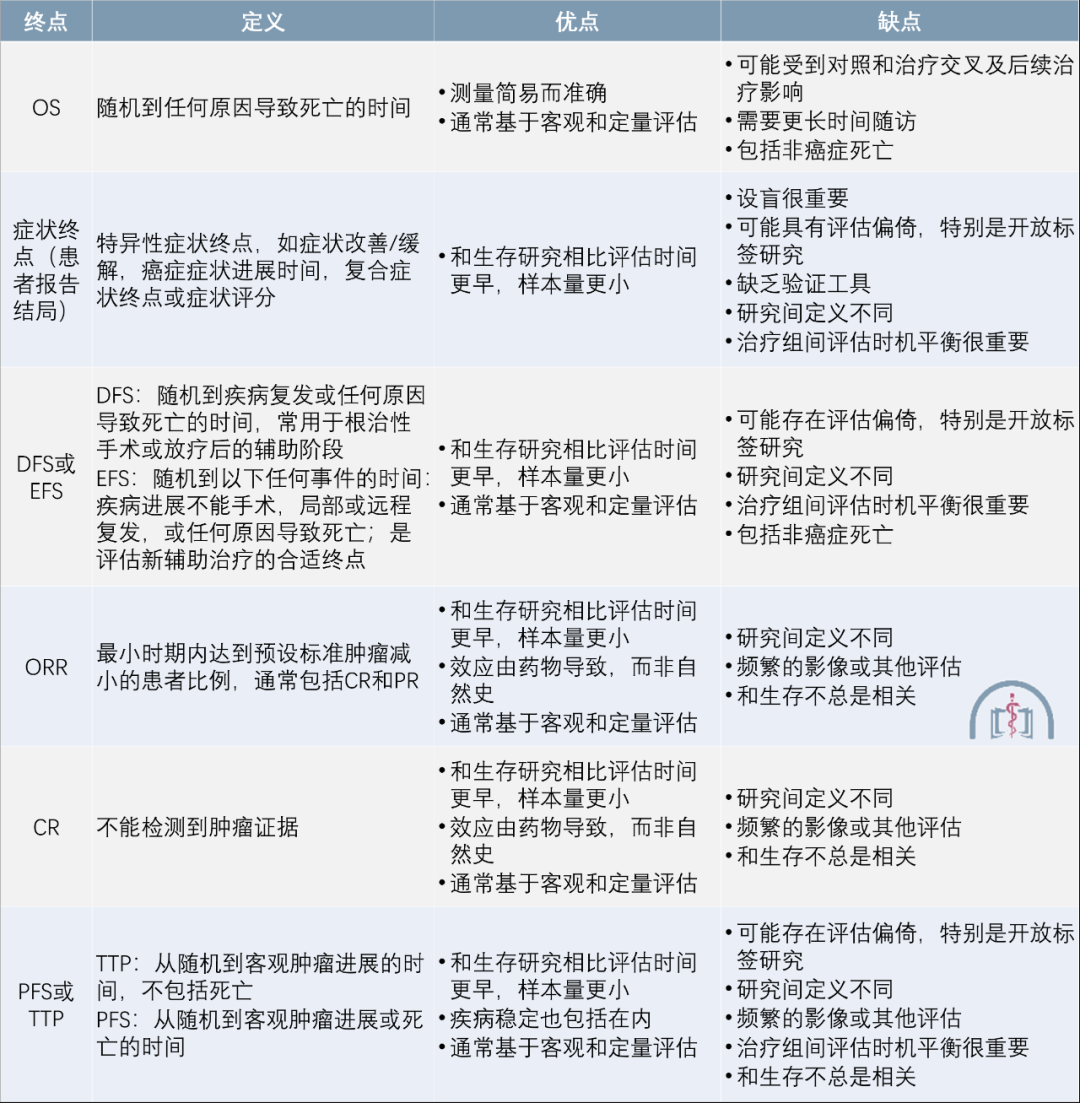
这些终点包括总生存(Overall Survival, OS),DFS,无事件生存期(Event Free Survival, EFS),ORR,CR,进展时间(Time To Progression, TTP)和 PFS(表 1,表 2)。
表 1 各临床终点的作用和推荐研究设计
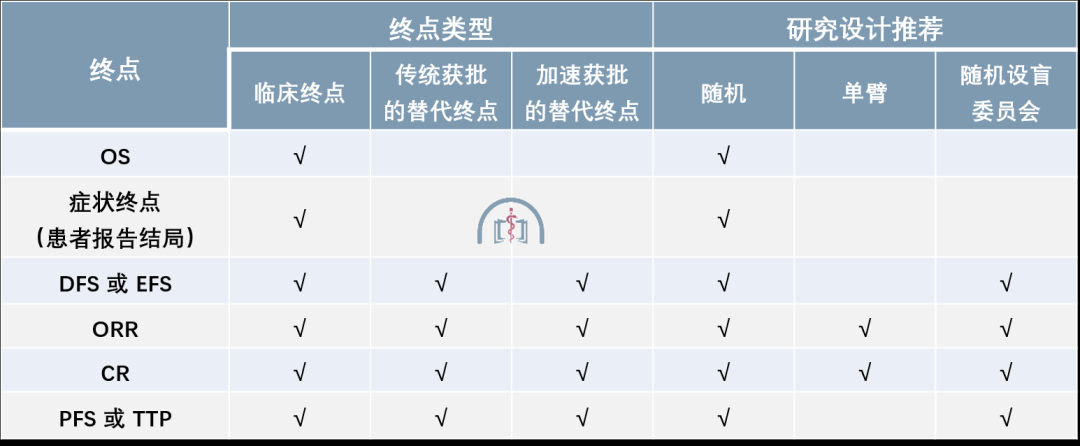
表2 常用生存和症状终点
2. 血液或体液为基础的生物标志物
通常血液或体液检测的生物标志物不能作为癌症药物获批的主要终点,只有多发性骨髓瘤血液或尿液蛋白水平可作为反应标准的一部分,持续的主要分子反应是慢性髓系白血病传统获批的替代终点。
FDA 接受血液为基础的标志物作为复合终点的一部分。例如在卵巢癌患者中,某些临床事件(一般状况的显著恶化,或肠梗阻)和 CA125 升高可认为是疾病进展。此外,血液为基础的生物标志物可用于发现预后因素,选择患者和作为分层因素。
3. 新型终点
随着科学的发展,FDA 认为可以有其他终点支持癌症药物的获批。例如最小残留病灶(Minimal Residual Disease, MRD)可作为急性淋巴母细胞白血病加速批准的替代终点,无转移生存可作为非转移性去势抵抗前列腺癌传统获批的临床终点。
近来,中国学者开发了免疫药物临床试验的替代终点——改良 PFS(modified PFS, mPFS)。mPFS 剔除了 3 个月内早期进展事件,也就是 3 个月内出现早期进展不计入事件,患者将继续随访至死亡或删失,并证实 mPFS 作为免疫治疗的 OS 替代终点表现优于 PFS[2]。这也反映了结合具体药物或疾病特性而不断改进的终点探索。
4. 具体应用
目前,各方专家越来越倾向于综合肿瘤生物学的异质性和自然史(图 1)、特定临床情境和安全性与疗效的平衡来设计临床研究和终点。例如在转移性乳腺癌中,目前推荐根据不同激素受体(Hormone Receptor, HR)和 HER2 情况、治疗线数来确定终点(表 3)[3]。
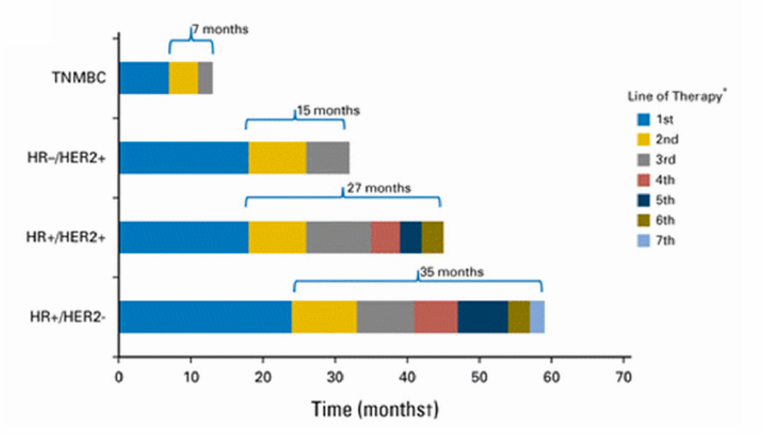
图 1 各类型转移性乳腺癌的病程(图源 DOI: 10.1200/EDBK_280451)
表 3 转移性乳腺癌的推荐临床试验终点
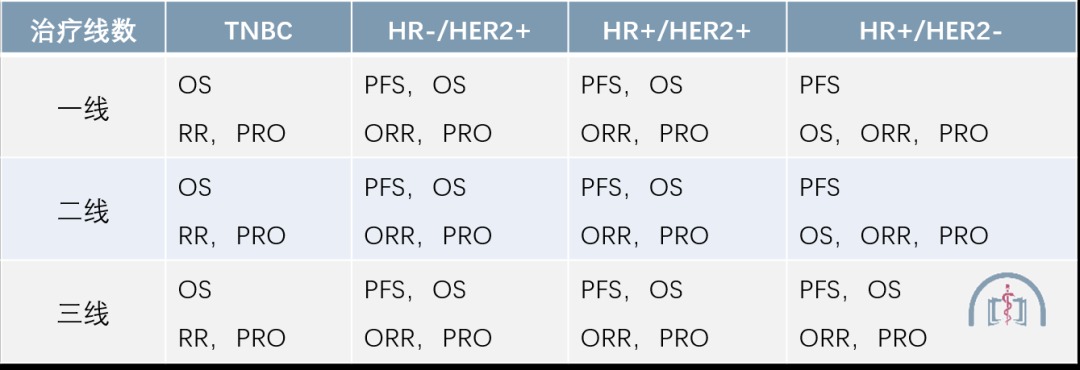
PRO:患者报告结局(Patient Reported Outcome)
特殊临床研究设计和考虑原则
1. 单臂研究
疾病当前无可行治疗,或可以推测主要肿瘤退缩由试验药物引起时,FDA 可以接受单臂研究的 ORR 和反应持续时间作为支持加速批准的证据。例如在急性白血病的传统批准中,CR 和输血降低、感染降低和生存增加相关。但是单臂研究评价 OS,DFS,PFS 等时间-事件终点的能力不足。
2. 随机研究证实非劣效
通过表明新药不劣于标准方案而证实新药有效性,此时标准方案需要有明确的临床获益。非劣效研究不建议使用 OS 和 ORR 外的终点。
3. 放疗和化疗保护剂的研究设计
放疗和化疗保护剂研究有两个目标,一是评估癌症治疗毒性缓解,二是评估是否损害抗肿瘤活性。后者常使用早期终点,如 ORR 或 PFS,而非 OS。
4. 临床研究设计原则
在开始临床研究前,应对试验设计,进展定义,统计学分析计划,处理丢失数据的方法和审查方法,病例报告表格(Case Report Form, CRF)记录的数据,独立终点评估委员会的操作程序做出清晰界定。
参考文献
[1] Clinical Trial Endpoints for the Approval of Cancer Drugs and Biologics: Guidance for Industry. 2018
[2] Seidman AD, et al. The Evolution of Clinical Trials in Metastatic Breast Cancer: Design Features and Endpoints That Matter. Am Soc Clin Oncol Educ Book. 2020;40:1-11.
[3] Wang ZX, et al. Exploration of modified progression-free survival as a novel surrogate endpoint for overall survival in immuno-oncology trials. J Immunother Cancer. 2021;9(4):e002114.
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx