为贯彻《药品管理法》有关规定,进一步加强药品上市后变更管理,国家药监局组织制定了《药品上市后变更管理办法(试行)》,现予发布,自发布之日起施行,此前规定与本公告不一致的,以本公告为准。
各省级药品监管部门应当落实辖区内药品上市后变更监管责任,细化工作要求,制定工作文件,明确工作时限,药品注册管理和生产监管应当加强配合,互为支撑,确保药品上市后变更监管工作平稳有序开展。
特此公告。
附件:1.药品上市后变更管理办法(试行)
2. 关于实施《药品上市后变更管理办法(试行)》的说明
3. 《药品上市后变更管理办法(试行)》政策解读
4. 药品上市许可持有人变更申报资料要求
国家药监局
2021年1月12日

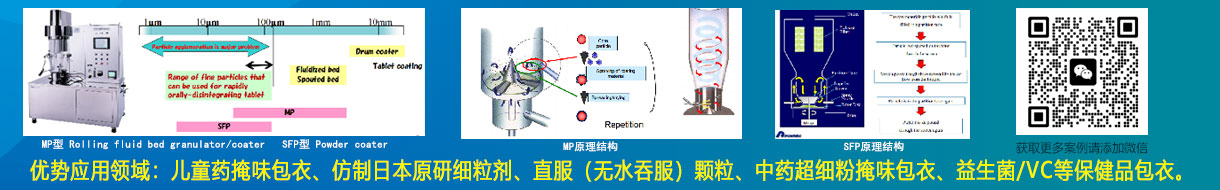
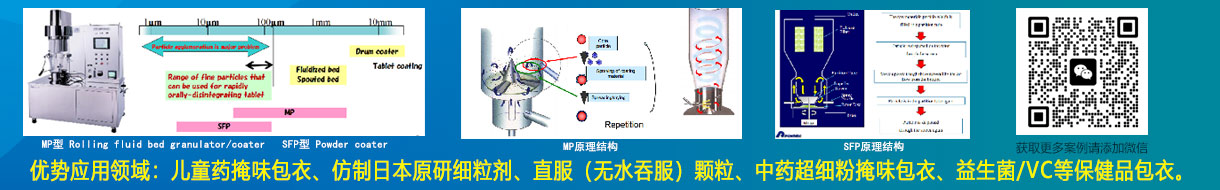


 PHEXCOM公众号
PHEXCOM公众号