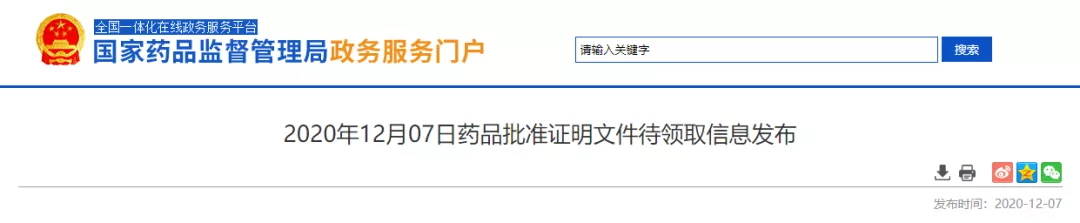
12 月 7 日,NMPA 最新批件显示,15 款仿制药新获批上市,其中 13 款以新注册分类获批并视同通过一致性评价;另外,10 款仿制药以补充申请通过了一致性评价。
根据 Insight 数据库,本次共 7 个品种迎来了首家过评,另有 7 个品种前三家过评。
豪森「注射用盐酸吉西他滨」首家过评
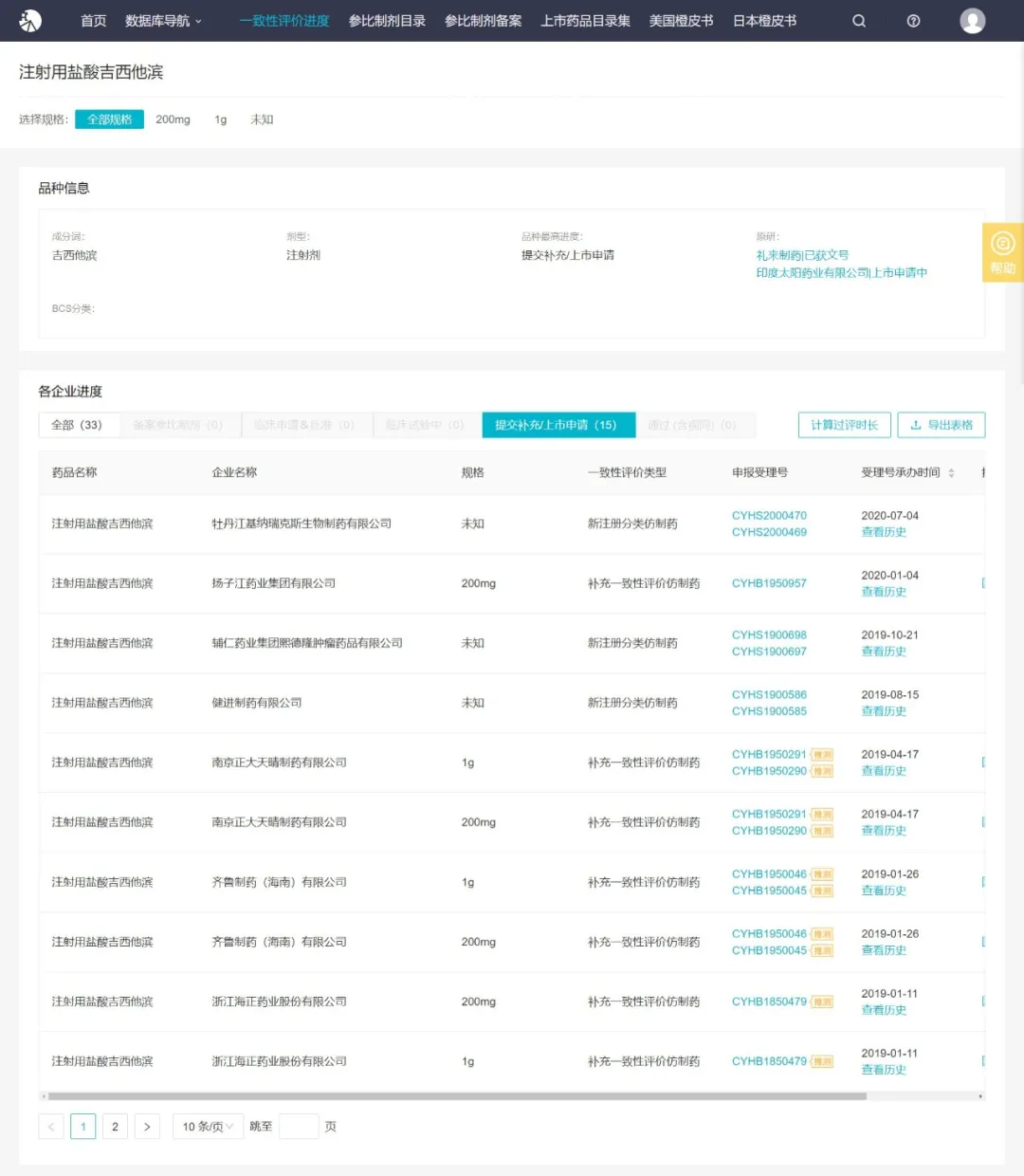
Insight 数据库显示,包括豪森在内,注射用盐酸吉西他滨目前已有 6 家企业提交补充申请,4 家企业提交新注册分类上市申请,13 家企业暂无进度。豪森本次过评,为该品种首家。
来自:Insight 一致性评价数据库
(http://db.dxy.cn/v5/home/)
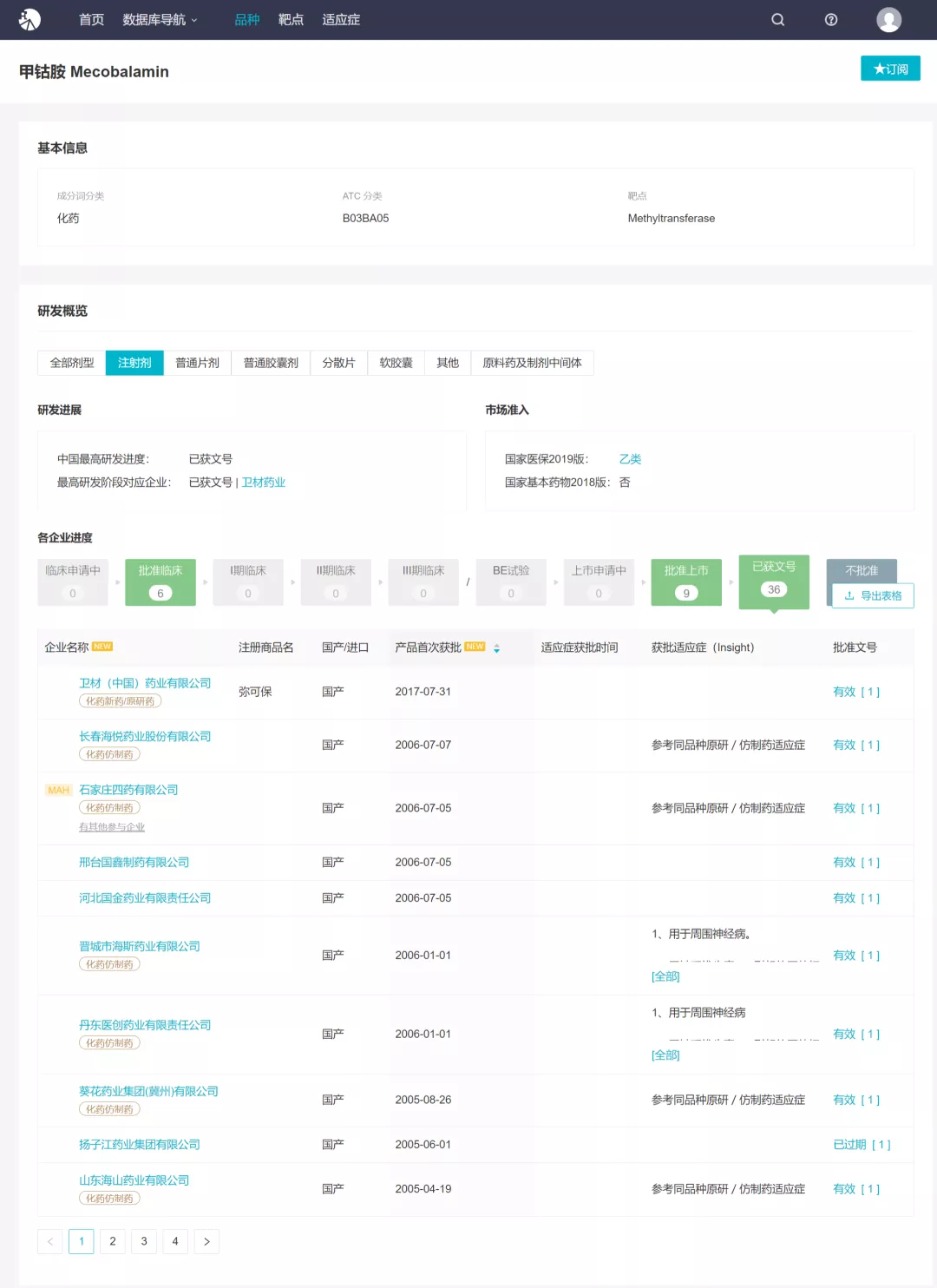
扬子江「甲钴胺注射液」首家过评,「注射用培美曲塞二钠」第 3 家过评
Insight 数据库显示,甲钴胺注射液属于国家医保乙类,目前已有 36 个企业拥有文号,但在本次扬子江过评之前,该品种无企业过评。根据 Insight 数据库,目前除扬子江外,该品种也暂无其他企业递交补充/上市申请。
来自:Insight 数据库(http://db.dxy.cn/v5/home/)
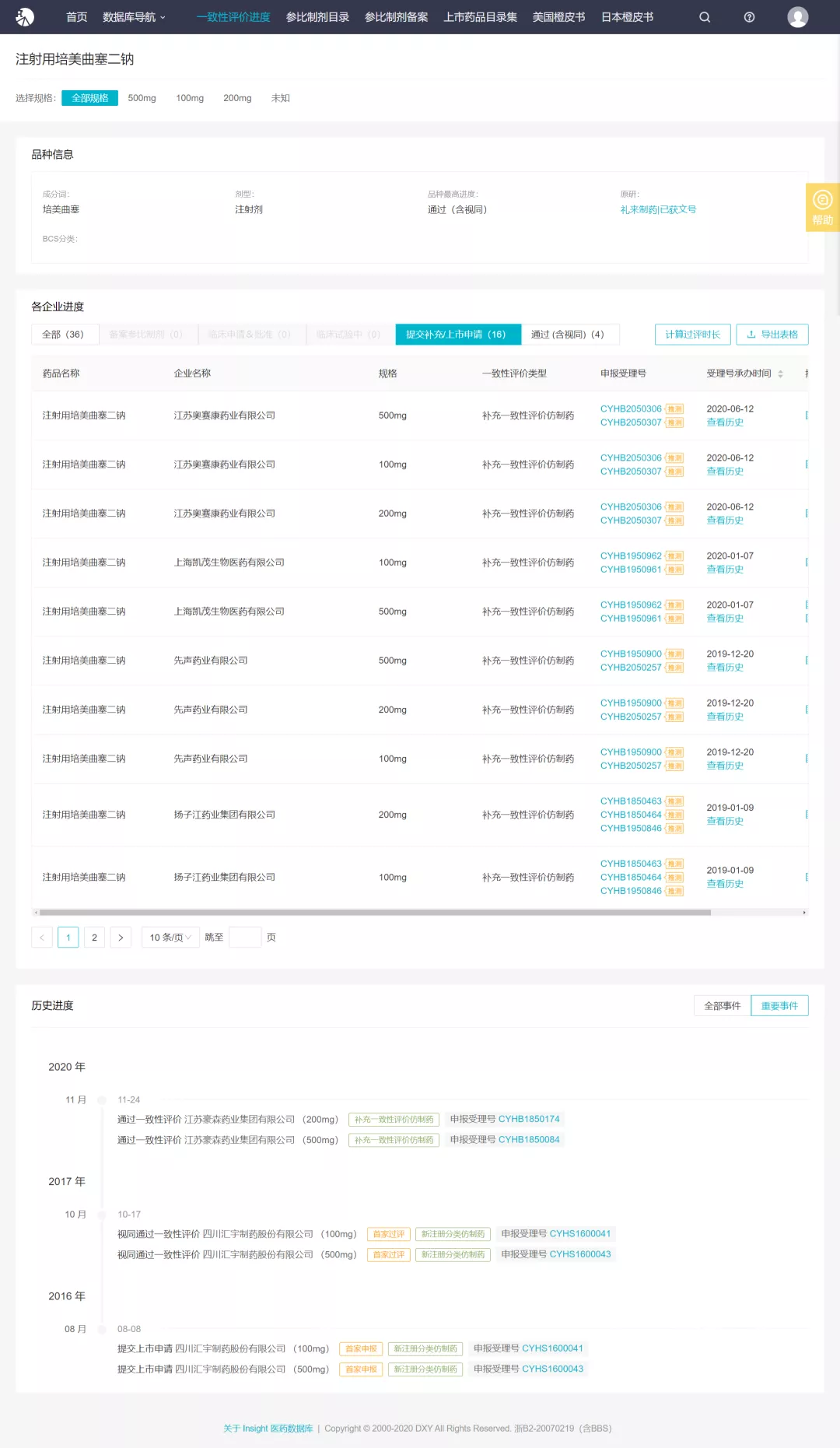
注射用培美曲塞二钠为 4+7 集采品种。根据 Insight 一致性评价数据库,目前已有 2 家企业通过一致性评价:四川汇宇药业在 2017 年 10 月以新注册分类仿制药获批而视同通过一致性评价,豪森药业在今年 11 月 24 日补充申请通过了一致性评价。本次扬子江过评为该品种第 3 家过评,此外另有 4 家企业已递交一致性评价补充申请,3 家企业已递交仿制药上市申请。
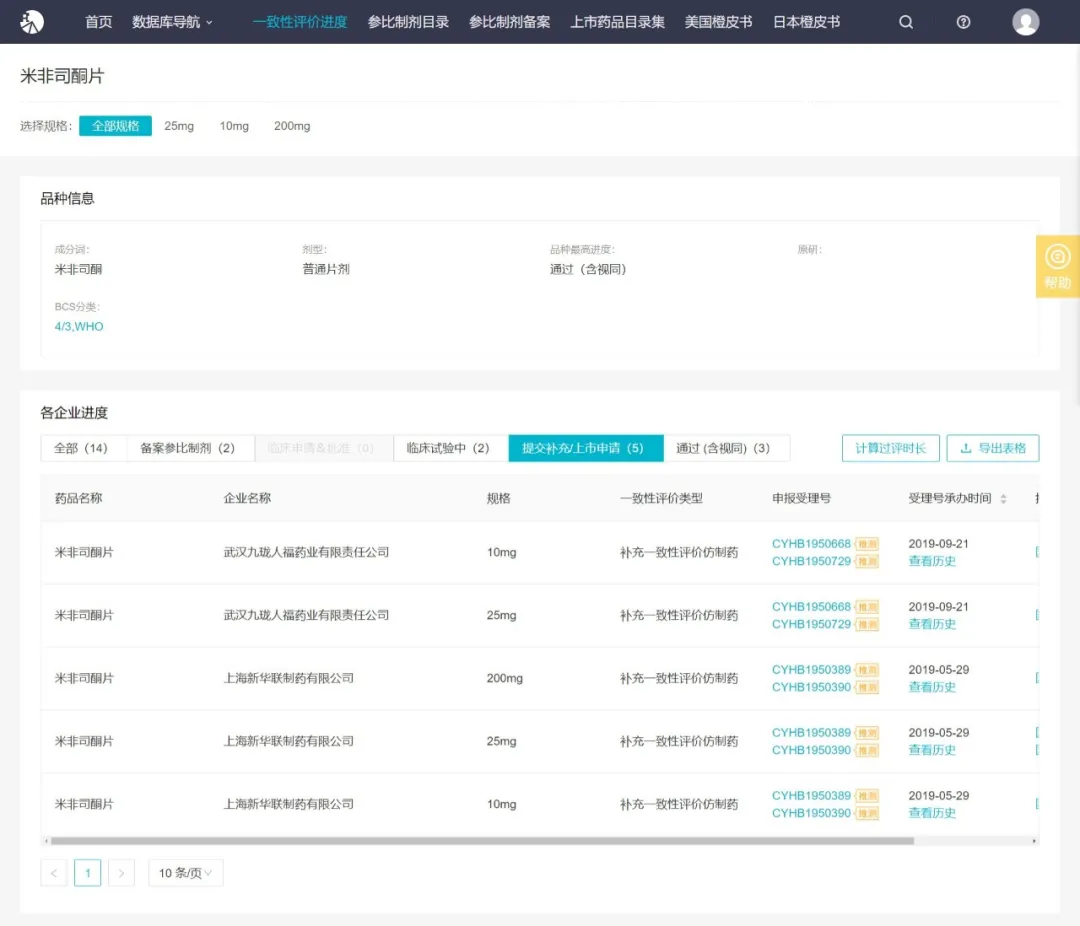
人福药业「米非司酮片」第 2 家过评
Insight 数据库显示,人福药业「米非司酮片」本次过评为该品种第 2 家过评,首家为华润紫竹药业。另外,上海新华联制药业提交了一致性评价补充申请。2 家企业处于 BE 试验阶段,分别是浙江仙珺制药和广东朗圣药业;另有 2 家企业已备案参比。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx