随着新药研发的日益增多,模型分析技术在药物研发中的应用越来越广泛。为鼓励创新药提高研发效率,引导基于模型的分析方法在药物研发中的合理使用,药品审评中心组织起草了<模型引导的药物研发技术指导原则(征求意见稿)>。
我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。
您的反馈意见请发到以下联系人的邮箱:
联系人:李健;王玉珠
联系方式:lijian@cde.org.cn;wangyzh@cde.org.c
感谢您的参与和大力支持。
国家药品监督管理局药品审评中心
2020年8月3日
原文链接:(复制链接,用浏览器打开)
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=2bd8ee6adf9e111f
模型引导的药物研发技术指导原则(征求意见
目录
一、概述
二、基本理念
三、模型分析在药物研发中的应用
四、用于模型分析的数据来源和质量
五、模型分析的实施
(一)质量控制
(二)模型假设
(三)模型验证
(四)基于模型的分析计划
(五)基于模型的分析报告
六、监管考虑
七、参考文献
1概述
模型引导的药物研发(Model-Informed Drug Development, MIDD)通过采用建模与模拟技术对生理学、药理学以及疾病过程等信息进行整合和定量研究,从而指导新药研发和决策。建模与模拟技术已在国际上应用于药物研发的多个阶段,可在药物研发的多个关键决策点发挥重要作用,国内在此方面的应用尚处于起步阶段。为引导和规范MIDD相关方法的合理使用,提高药物研发效率,制定本指导原则,旨在提出模型引导药物研发的一般考虑。本指导原则仅代表药品监管部门当前的观点和认识。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。应用本指导原则时,还请同时参考药物临床试验质量管理规范(GCP)、国际人用药品注册技术协调会(ICH)和其他国内外已发布的相关指导原则。
内容由凡默谷小编查阅文献选取,排版与编辑为原创。如转载,请尊重劳动成果,注明来源于凡默谷公众号。
2 基本理念
基于模型的分析方法在新药研发领域的应用已有一定的历史,在不同历史发展时期,其在不同文献资料中存在不同术语:建模与模拟(Modeling and simulation)、定量药理学(Pharmacometrics)、模型辅助的药物研发(Model-aided drug development)、基于模型的药物研发(Model-based drug development)、模型引导的药物研发(MIDD),等。MIDD是国际上新近提出的常用术语,用于描述基于模型的分析方法在药物研发及决策制定中的应用。MIDD在药物研发及其全生命周期管理中的应用涉及多个方面,涵盖从非临床到临床研究以及上市后临床再评价的各个阶段(图1)。基于分析技术和应用场景的不同,常用的模型种类包括但不限于:群体药代动力学(Population pharmacokinetics, PopPK)模型、药代动力学/药效学(Pharmacokinetics/pharmacodynamics, PK/PD)模型、剂量-暴露量-反应关系(Dose-exposure-response relationship)分析、基于生理的药代动力学(Physiologically based pharmacokinetics, PBPK)模型、疾病进展模型(Disease progression model)、基于模型的荟萃分析(Model-based Meta-analysis, MBMA),等。国际上已有多个药物研发案例证明了MIDD方法在指导药物研发、上市以及全生命周期管理中的价值。具体而言,通过建模与模拟技术对生理学、药理学以及疾病过程等信息进行定量分析,使研究者深入理解药物的作用机理、作用特点、疾病发生发展的原理和进程等,从而为企业内部的研发决策、剂量选择、以及药物在患者亚群体中用法用量的调整等提供支持,相关信息还可用于支持药品说明书的撰写,评估获益风险比,增加研究者对后续研发的信心。通常,科学合理的模型分析结果可以为研究者提供较强的“证据基础”,对于药物研发决策的制定和方向具有指导意义。模型,特别是基于机理的模型,是总结既往的已有知识或数据然后据此预测未来结果的工具。从提高药物研发效率的角度出发,参与新药研发的研究者和决策者应合理运用MIDD技术,在药物研发的关键点(如:II/III期临床试验前)积极寻求基于一个或多个相关联模型分析的证据,结合模型分析结果和实际临床验证结果,循环更新模型和模拟预测,综合判断后续研究方向。建议参与模型分析的专业人员在药物研发过程中尽早介入,尽可能全程参与研究设计和数据分析,形成模型引导的药物研发模式,提高研发效率的同时降低研发成本。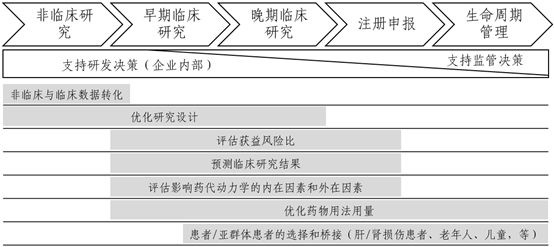
图1. MIDD在药物研发生命周期中的应用示意图
3 模型分析在药物研发中的应用
模型分析的意义在于其对药物研发决策的支持和指导,主要体现在模型预测结果与真实研究结果的循环递进和相互补充。模型分析与真实研究的关系应遵循“学习与确认” 循环(Learn and confirm cycle),两者应是一个有机整体,研究者通过已有信息建立模型,预测相关研究结果,然后进一步通过真实研究数据验证模型分析结果的可靠性,并随着研发过程的推进对模型进行不断更新和完善,从而实现模型与真实研究的共同推进。此外,研究者还需关注药物研发不同阶段,为回答研发过程中一系列问题而开发的不同模型(如:疾病进展模型和剂量-暴露量-反应关系模型等)之间的联系。模型分析在药物研发中的应用范围较广泛,包括但不限于指导药物研究方案设计、优化用法用量、分析影响药物体内行为的内在因素和外在因素、对患者亚群体(如:老年人、儿童、肝/肾功能损伤患者、不同种族患者、不同基因型患者,等)用法用量的调整提供支持、对与临床终点相关生物标志物或替代终点的选择提供支持,等。基于模型种类的差异和应用场景的不同,分析方法存在差异,具体技术要求可参考国内外相关技术指导原则。
4 用于模型分析的数据来源和质量
数据质量是保证模型分析可靠性的根本前提。推荐采用具有充分质量保证的实际研究中收集的数据进行模型分析。特殊情况下,研究者出于了解疾病进展过程、药物作用机理、初步评估药物效应等目的,也可采用药物在临床实践中收集的数据或文献报道的相关研究数据开展模型分析。考虑到该类数据的来源可能未经严格质量控制,数据选择可能存在偏倚,数据质量无法得到充分保证,基于该类数据开展的模型分析结果应谨慎解读。研究者应确保用于模型分析数据的真实性和可靠性。同时,对于可能影响重要决策的模型分析,研究者应确保纳入模型分析的数据量足够且具有代表性,以充分支持相应的研究目的。用于模型分析的数据量充分程度可直接影响相关研究结果的可靠程度。
5 模型分析的实施
(一)质量控制为确保基于模型的分析结果回答的科学问题准确可靠,研究者应对分析的全部过程进行严格的质量控制。除常规质量控制要求外,还应重点关注以下方面:研究者应保证数据、分析流程等的完整性,确保可从最终报告的分析结果追溯到模型分析所用的原始数据库,保留稽查轨迹或过程操作轨迹。分析人员应接受过专业培训。相关软件应能满足相应的研究目的。为进一步确保模型分析的质量,建议由未直接参与分析的专业人员进行独立的审核,主要根据研究目的严格评估分析过程和结果的科学性。质量控制的审核包括从原始数据到最终数据集的生成、模型描述、模型代码、及其他相关分析代码(例如,诊断图代码、模拟代码),等。对于分析报告,应对分析报告内容(包括图和表格)、归纳总结过程中涉及数据的完整性和准确性进行审核,确保报告中记录的数值与软件输出的一致。
(二)模型假设模型假设是模型分析的重要部分。需关注模型假设可能带来一定的不确定性。模型的假设应在符合生理学、药理学以及疾病进展基本特征的基础上提出,应具有科学性和合理性,否则可能影响基于模型分析获得的相关结论的科学性。通常,重要的模型假设应由包括模型分析的专业人员、疾病领域专家、统计学家等在内的项目团队共同决策。模型分析中使用的假设,应提供完整清晰的科学依据,并需考虑模型假设对分析结果的影响。模型假设的使用和评估应遵循“学习与确认”循环,以便在后续试验中对错误假设进行辨别。模型分析结果用于药物研发的重要决策时,建议明确阐述模型假设并特别关注假设的验证及其可接受性,以降低错误假设导致决策错误的风险。通常,模型假设可采用模型诊断、敏感性分析、或常规推理等方法进行验证。对不能基于已有数据或通过后续研究进行验证的假设,通常应开展适当的敏感性分析,评估不同假设对模型分析结果的影响。
(三)模型验证模型验证是对所建模型的可靠性和稳健性进行评价的过程,是模型分析的重要步骤。研究者应基于模型特点、分析目的等选择合适的方法进行验证。每种模型验证方法具有相对的优势和不足,通常只能评价模型某一方面的特征,因此建议采用多种方法对模型进行综合评估。模型验证结果显示不合适的,建议重新建立模型或对模型进行优化。
(四)基于模型的分析计划建议制定模型引导药物研发的整体计划,包括拟定的临床研究计划、拟收集的数据、以及模型分析计划等,考虑药物研发进程中各阶段的模型分析策略以及需通过模型分析回答的问题,并讨论各阶段模型分析计划之间以及与真实临床研究计划之间的内在联系。MIDD计划可随研究进程的推进而不断完善和更新,以适应药物研发不同阶段的研究目的。通常,药物研发早期的模型分析多数用于支持企业内部的研发决策(如:剂量选择,研发的继续/放弃),该类分析的实施情况由企业内部自行评估和决定,可参考本指导原则的科学性考虑。对于临床试验后期的模型分析,若拟作为药物注册上市的支持性证据,企业应提供充分证据证明模型分析的科学性和可靠性,相关资料中应包括事先制定的分析计划。模型分析应有清晰的研究目的,建议基于研究目的制定相应的分析计划,包括但不限于数据分析计划和模型模拟计划(表1)。分析过程中如需对分析计划进行修改,应保留修改痕迹或历史版本,并对修改内容的科学性进行论证。
(五)基于模型的分析报告模型分析结果如拟作为药物注册上市的支持性证据,应提供完整的分析报告(表1)。分析报告应提供足够详细的内容,确保药品监管部门可基于分析报告准确评估模型分析过程和结果,并对整个分析进行完整重复,以确保基于模型分析结果作出的科学判断准确可靠。表1.模型分析计划和分析报告的常用结构
6 监管考虑
已有药物研发经验表明,MIDD对药物研发决策的制定具有指导意义。在满足药品申报相关要求的前提下,鼓励相关研究人员提高MIDD意识,科学运用模型分析方法指导药物研发,提高研发效率。但是,研究者需充分认识到模型分析可能存在的不确定性,基于模型分析结果制定相关决策时,应综合评估获益风险比,并承担相应风险。MIDD的应用范围非常广泛,包含的定量模型种类较多。其中一部分模型在国际药品监管决策中应用较多,具有比较成熟的应用经验。采用该类模型进行分析的结果,在满足一定条件的情况下(包括但不限于模型分析符合相关指导原则要求),可考虑作为药物申报时对某些问题的支持性证据。研究者应确保用于模型分析的数据充足,并对模型进行充分验证,确保模型分析的科学性和可靠性。另外,还有一部分模型应用经验相对较少,对采用该类模型进行分析的结果需关注其不确定性,建议谨慎解读。通常,基于模型的分析在药物注册中的适用情况和可接受度等,需基于具体品种情况进行个案讨论。研究者应基于药物特征和模型分析目的等,对相关问题的科学合理性进行充分论证,包括但不限于:用于模型分析的数据的代表性和充分性、模型分析过程和结果的科学性、模型假设的合理性、研究结论对相关决策的适用性,等。特殊情况下,可与监管机构沟通。
7 参考文献
1. EFPIA MID3 Workgroup. White Paper - Good practices in model-informed drug discovery and development: practice, application, and documentation. CPT Pharmacometrics Syst. Pharmacol. (2016) 5, 93-122.
2. EMA Modelling and Simulation Working Group. Commentary on the MID3 good practices paper. CPT Pharmacometrics Syst. Pharmacol.(2017) 6, 416-417.
3. U.S. FDA. Guidance for Industry (Draft) - Population Pharmacokinetics. Jul.2019.
4. U.S. FDA. Guidance for Industry - End-of-Phase 2A Meetings. Sep. 2009.
5. U.S. FDA. Guidance for Industry - Physiologically Based Pharmacokinetic Analyses - Format and Content. Aug. 2018.
6. EMA. Guideline on reporting the results of population pharmacokinetic analyses.Jan.2008.
7. EMA. Guideline on the reporting of physiologically based pharmacokinetic (PBPK) modelling and simulation. Dec. 2018.
8. PMDA. Guideline on Population Pharmacokinetic and Pharmacodynamic Analysis. May. 2019.
9. ICH E4: Dose-response information to support drug registration. Mar. 1994.
10. Yaning Wang, Hao Zhu, Rajanikanth Madabushi, et al. Model-Informed Drug Development: Current US Regulatory Practice and Future Considerations. Clinical Pharmacology & Therapeutics, 2019, 105(4): 899-911.
11. (原)国家食品药品监督管理总局. <成人用药数据外推至儿科人群的技术指导原则>,2017年5月.
12. (原)国家食品药品监督管理总局. <抗菌药物药代动力学药效学研究技术指导原则>,2017年8月.
13. (原)国家食品药品监督管理总局. <药物临床试验的一般考虑指导原则>,2017年1月.
14. 新药研发中定量药理学研究的价值及其一般考虑. 中国临床药理学与治疗学, 2018, 23(9): 961-973.
15. 新药研发中群体药动学/药效学研究的一般考虑. 中国临床药理学与治疗学, 2019, 24(11): 1201-1220.
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx