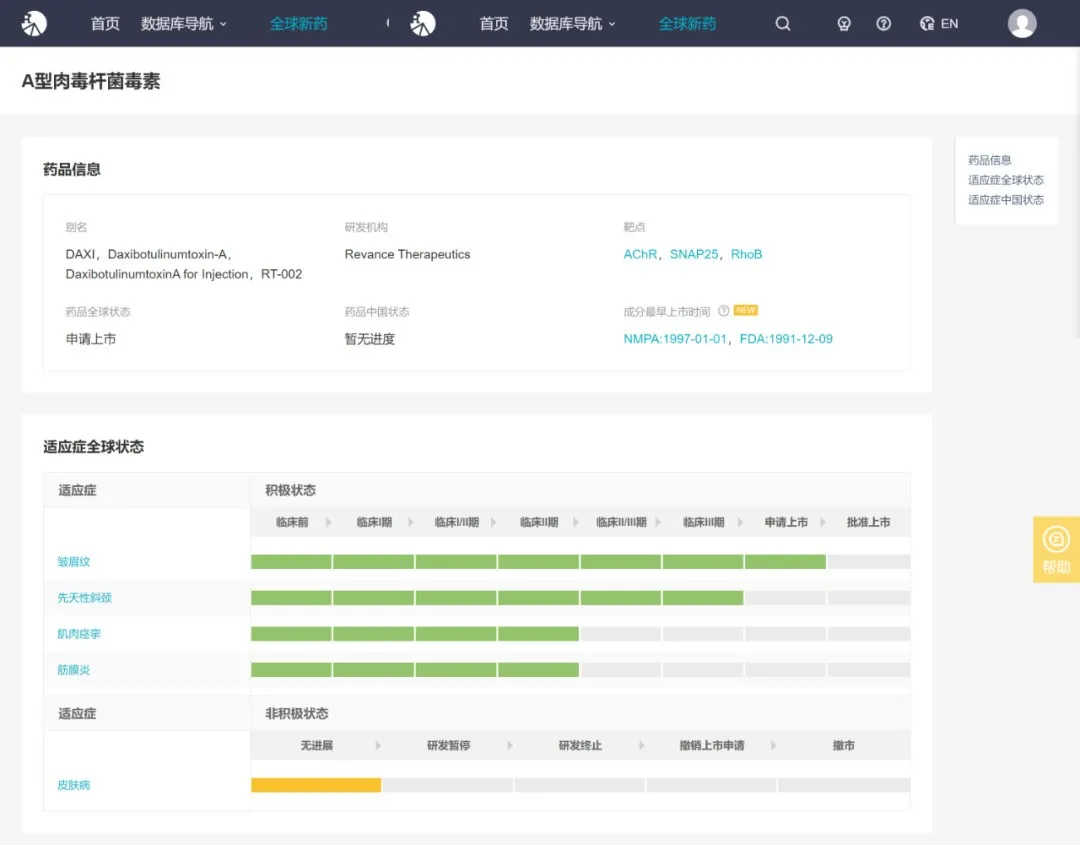
9 月 24 日,CDE 官网显示,复星医药获美国 Revance Therapeutics 公司授权的 DaxibotulinumtoxinA 在国内获批第二项临床,用于孤立性颈部肌张力障碍。此前,于 9 月 21 日,其用于中重度眉间纹已获批临床。

RT002(注射用 DaxibotulinumtoxinA),复星医药于 2018 年 12 月获美国 Revance 授权在区域内(即中国大陆、香港及澳门特别行政区,下同)独家使用、进口、销售及其他商业化(不包括制造)的权利,Revance 仍为该新药在区域内的权利人。
该新药为生物制品,拟用于:(1)美容适应症,如治疗中重度眉间纹;以及(2)治疗适应症,如颈部肌张力障碍。
Insight 数据库显示(http://db.dxy.cn/v5/),该新药用于中重度眉间纹治疗尚处于美国 FDA 上市申请阶段,用于颈部肌张力障碍治疗于美国处于 III 期临床试验中。
来源:Insight 数据库(http://db.dxy.cn/v5/)
目前,国内尚无 Daxibotulinumtoxin A 型肉毒杆菌毒素的产品上市销售,国内已上市的类似产品 A 型肉毒杆菌毒素包括 Allergan plc 的 Botox® A 型肉毒杆菌毒素、兰州生物制品研究所有限责任公司的衡力®治疗用 A 型肉毒杆菌毒素。根据 IQVIA CHPA 最新数据,2019 年度,注射用 A 型肉毒杆菌毒素在中国境内销售金额约为人民币 3.54 亿元。
此前复兴医药公告显示,截至 2020 年 5 月,集团现阶段针对该新药累计研发投入为人民币约 21,131 万元(未经审计;包括许可费)。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx