在日前举行的第三批全国药品带量采购视频会议上,新一轮带量采购工作预计将于7月份正式启动。随着化学药品注射剂仿制药质量和疗效一致性评价工作推进,理顺注射剂一致性评价与带量采购的关系,合理遴选采购品种,根据临床反馈不断完善治疗用药,谨慎处理临床药物替换,具有重要的现实意义。
多组分生化药工艺复杂
产品质量重点关注
今年5月,国家药品监督管理局发布<国家药监局关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告>,药品审评中心(CDE)随后配套发布了<化学药品注射剂仿制药质量和疗效一致性评价技术要求>,贯彻落实加快推进仿制药一致性评价的工作部署。
注射剂本身的特殊给药途径和临床应用范围决定了其高风险特点,处方、工艺研究的不彻底,很可能带来产品质量稳定性问题,进而造成疗效和安全问题。鉴于注射剂产品高风险特点,特别是对于一些特殊的注射剂,如原料药特别复杂的生物化学类药物等,一致性评价工作需要合理的政策引导和监管。
生物化学类药物是以生物材料为原料经化学工艺制得,与化学药物相比,生物制剂的并非单一成分,而是组分复杂,结构难确定,且对热、酸、碱、重金属及 pH 均较敏感,生产工艺中易引入特殊杂质和污染物等。以原研依诺肝素钠为例,该药物就是以猪肠黏膜组织为生产起始原料,由于生产工艺复杂,到目前为止也只有70%的结构能够被充分表征,仍有30%无法表征。
国际上,欧洲药品管理局(EMA)、美国食品药品监督管理局(FDA)、世界卫生组织(WHO)等机构均认识到低分子肝素类药物(LMWH)的复杂性,从药物原料生产工艺,到全过程质量控制,都对药物成品质量有着决定性影响。
中国药品监管部门对于包括低分子肝素在内的复杂注射剂的质量控制和安全监管投入了高度关注。早在2008年“肝素钠事件”中,药监部门在原料中查出“多硫酸软骨素”是造成多例患者死亡的不能排除的风险因素;近年来,监管机构持续推进相关品种规范管理,包括<中华人民共和国药典>标准修订工作,监管力度不断升级。
低分子肝素替换须合理
带量采购综合考量
国家推动的药品集中带量采购降低患者费用负担,提高了临床用药质量水平,同时加速企业间的竞争转为公开透明的产品质量和成本竞争,从根本上改善了医药行业生态。出台注射剂一致性评价政策文件或指导原则,制定评价标准是产品纳入带量采购的基础。
目前,中国尚缺乏针对复杂的生物化学类注射剂产品的一致性评价技术指南,最新发布的<化学药品注射剂仿制药质量和疗效一致性评价技术要求>明确:对于特殊注射剂,除了按照技术要求开展研究的同时,还需根据特殊注射剂的特点,参照FDA、EMA发布的特殊注射剂相关技术要求,科学设计试验。
基于科学标准研判,在药品纳入带量采购时,有必要对具有特殊性及高风险药品具体考量。事实上,低分子肝素由于生产工艺的不同,包括依诺肝素钠、那屈肝素钙和达肝素钠等不同通用名产品,中国国家药典委已于2017年6月发布了关于依诺肝素钠、那屈肝素钙、达肝素钠的草案药典标准,这些按照药典分类的低分子肝素产品,一致性评价工作正在进行中,行业建议对这类产品不纳入或延缓纳入省级集采。
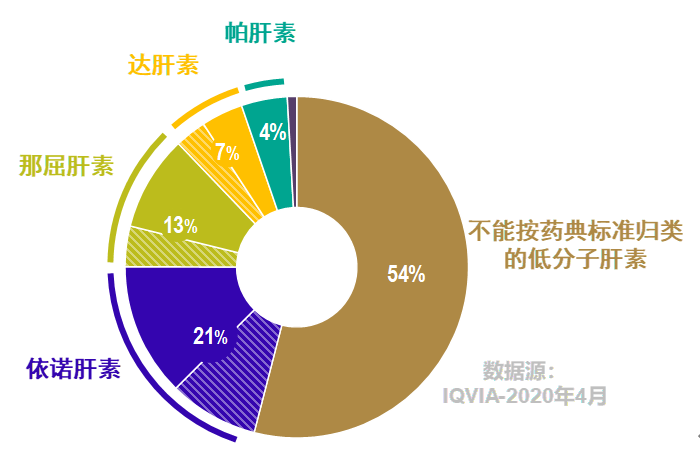
此外,中国低分子肝素市场还有大量不能按照药典标准归类到某一通用名、也无法确定参比制剂的低分子肝素产品。根据2020年4月第三方机构(IQVIA)数据显示:不能按药典标准归类的低分子肝素产品占到整个低分子肝素用量的54%,这类低分子肝素没有一致性评价的参比制剂,难以通过BE试验完成一致性评价,无法参与国家层面的集采,或是省级集采可以考虑纳入的品类。
临床使用方面,不同低分子肝素的抗Xa与抗IIa比例不同,欧美的药品监管部门针对低分子肝素之间临床替换的安全性风险高度重视,尤其是肝素或低分子肝素产品治疗可能导致的潜在致死性免疫原性相关不良事件_肝素诱导的血小板减少症(HIT)。因此,仿制产品和原研产品的疗效差异等问题,合理用药不容忽视。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx