这 33 个药品,不通过一致性评价!
发布者:国际药物制剂网
发表时间:2020/7/7 点击:
616
次
目前来看,一个品种通过一致性评价所需要的费用少则几百万,多则上千万。当然,不批准回炉再造的可能这个费用还要高。
据 Insight 数据库统计,截至 2020 年 6 月不通过一致性评价的药品已有 33 个,其中 6 个品种明确为「不批准一致性评价」,3 个品种大概率不批准,其余 24 个药品为企业申报一致性评价最后批准临床。
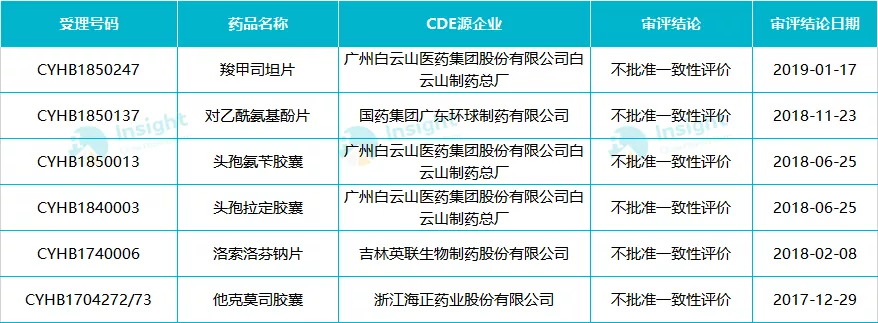 6 个药品明确不批准一致性评价
从公开数据来看,目前有 6 个药品明确不批准一致性评价,涉及 4 家国内制药企业,分别是广州白云山、国药集团广东环球制药、吉林英联生物和海正药业。
6 个药品明确不批准一致性评价
从公开数据来看,目前有 6 个药品明确不批准一致性评价,涉及 4 家国内制药企业,分别是广州白云山、国药集团广东环球制药、吉林英联生物和海正药业。
1、广州白云山 3 个品种不过评
6 个品种中,广州白云山包揽 3 个,此前官方也公布了不通过一致性评价额原因。
头孢氨苄胶囊和头孢拉定胶囊
据此前公开的信息显示,广州白云山的头孢氨苄胶囊和头孢拉定胶囊是由于「申请豁免 BE 试验遭拒」,羧甲司坦片不通过一致性评价原因暂时不详。
据 Insight 数据库显示,白云山在 2018 年 9 月开展了头孢氨苄胶囊的生物等效性试验,并于 2019 年 7 月再次递交了该品种的一致性评价补充申请,目前处于审评审批中。而该品种目前已有 4 家企业过评,还有 10 家企业递交了一致性评价补充申请。
头孢拉定胶囊也是同样的操作过程,目前白云山已补做完 BE 试验,重新递交补充申请。
羧甲司坦片
对于羧甲司坦片不通过的原因,白云山制药总厂曾发公告表示「按照一致性评价审评审批法规要求,经研究,白云山制药认为该项目 BE 研究的批量较小且产品储存条件与参比制剂有差异,故主动申请撤回。白云山制药总厂拟根据国家药监局关于药品审评审批的政策和相关技术要求,安排相关研发工作,拟补充完善后重新提交一致性评价申请」。
Insight 数据库显示,目前暂未在 CDE 查询到白云山该产品最新的申报信息。目前该品种尚无企业通过一致性评价。
羧甲司坦片是一种痰液调节剂,可影响支气管腺体的分泌,降低痰液的粘滞性。用于治疗慢性支气管炎、支气管哮喘等疾病引起的痰液粘稠、咳痰困难等症状。公开数据显示,羧甲司坦 2017 年重点城市公立医院销售 1585 万元,其中北京诚济制药和白云山制药总厂占主导地位,分别占比 48% 和 39%。
从销售额可以猜测到,该品种销售收入覆盖不了一致性评价的成本,数据也显示该品种文号持有的企业大部分选择沉默。Insight 数据库显示目前该品种只有临沂山松药业正在开展 BE,白云山汤阴东泰药业和广东华南药业备案参比制剂,另有 109 个文号暂无进展。
目前来看,大品种必做一致性评价,对于小品种大多数企业可能选择沉默,甚至最终默默消失。
2、海正他克莫司胶囊
海正的他克莫司胶囊未过一致性评价,此前 CDE 给出的专业原因指出「该品在 2015 年后欧洲原注册申报国家未予再注册,无法提供近年来原上市国家临床使用情况和不良反应信息,且本品在国内属于窄治疗指数药物,我国对此类药物的 BE 试验有相关技术要求,国外 BE 试验资料显示 Cmax 的 90% 置信区间为 105.563%-117.928%,未落在我国关于窄治疗窗药物要求的 90.00%-111.11% 范围内。他克莫司胶囊为窄治疗指数药物,开发难度大,国内目前尚无企业申报本品的一致性评价。」
他克莫司是一种强效免疫抑制剂,用于预防肝、肾、心脏移植后术后器官排斥反应,治疗肝脏或肾脏移植术后应用其他免疫抑制药物无法控制的移植物排斥反应。原研药由日本藤泽(Fujisawa)公司(现安斯泰来)开发,1993 年在日本上市,国内在 2001 年获批进口。2008 年,海正国内首仿上市。
公开数据显示,他克莫司属于重磅药品,全球销售额峰值达到 22 亿美元,目前国内除了进口原研外还有 4 家国产仿制药获批,但是目前均未过评。
3、对乙酰氨基酚片、洛索洛芬钠片
国药集团广东环球制药的对乙酰氨基酚片、吉林英联的洛索洛芬钠片,不批准原因不详,不过在 BE 试验未找到该企业该品种的试验。
4、正大天晴 2 个注射剂
注射剂一致性评价具体的技术要求文件在 2020 年 5 月份正式落地,至今通过一致性评价的注射剂品种少之又少,但是据 Insight 数据库统计,截止 6 月 16 日已有 752 个注射剂一致性评价受理号递交补充申请,涉及 172 家企业,但是都没有审评结论。
6 月 16 日,NMPA 官网发布的一批品审批意见通知件待领取信息显示,正大天晴 2 个注射剂品种递交的一致性评价补充申请没有发送批准证明文件,而是发送药品审批意见,这意味着这 2 个品种极有可能不批准一致性评价,2 个品种分别是钆塞酸二钠注射液和盐酸帕洛诺司琼注射液。
正大天晴钆塞酸二钠注射液在 2019 年 6 月以首仿国内获批,但是注册分类是老 6 类,需要开展一致性评价,但是并未查到其有开展 BE 试验。目前,科伦药业已经按照新注册分类 4 类递交了该品种的上市申请,看来该品种的一致性评价是早晚都要做。
盐酸帕洛诺司琼注射液是天晴按照老注册分类 3.1 类申报,在 2006 年获批上市;目前该品种国内已有 14 家仿制药获批,目前均未通过一致性评价。
5、华中药业头孢氨苄胶囊
6 月 19 日,在国家药监局公布的药品审批意见通知件待领取信息中,华中药业递交的头孢氨苄胶囊一致性评价补充申请并未收到批准证明文件,而是审评意见,意味着该品种极有可能未通过一致性评价。
Insight 数据库显示,华中药业在 2019 年 3 月就启动了该品种的生物等效性试验,在同年 11 月递交该品种一致性评价补充申请,如果确实未通关一致性评价着实有些可惜。
该品种是国家第二批集采品种,目前已有 9 家企业通过一致性评价,此外还有 270 个文号暂无进展。
24 个品种获批临床
据 Insight 数据库统计,截止 2020 年 6 月中旬,共有 42 个一致性评价受理号最终审评结论为批准临床,涉及不同企业的 24 个品种,其中,获批临床最多的品种是雷尼替丁胶囊,共计 13 家企业。
雷尼替丁有 13 家企业批准开展临床
雷尼替丁大家并不陌生,正是前一段时间因发现存在一种可致癌的亚硝酸胺杂质_N-亚硝基二甲胺(NDMA)而被 FDA 全部下架的药物。
国内也采取了措施,在 2019 年 12 月,药典委发布了雷尼替丁相关药物的药品标准修订草案公示,雷尼替丁标准拟增加 NDMA 杂质控制。
Insight 数据库显示,目前雷尼替丁申报一致性评价补充申请的企业共有 24 个受理号(涉及 20 家企业),其中有 14 个获批临床;目前只有 2 家企业通过一致性评价,分别是石药集团盐酸雷尼替丁胶囊和瑞阳制药的盐酸雷尼替丁片。
雷尼替丁是目前一致性评价获批临床最多的品种,猜测是因为药品标准修订后,需要增加 NDMA 杂质控制缘由。
附:所有一致性评价获批临床的药品(统计截至 2020 年 6 月)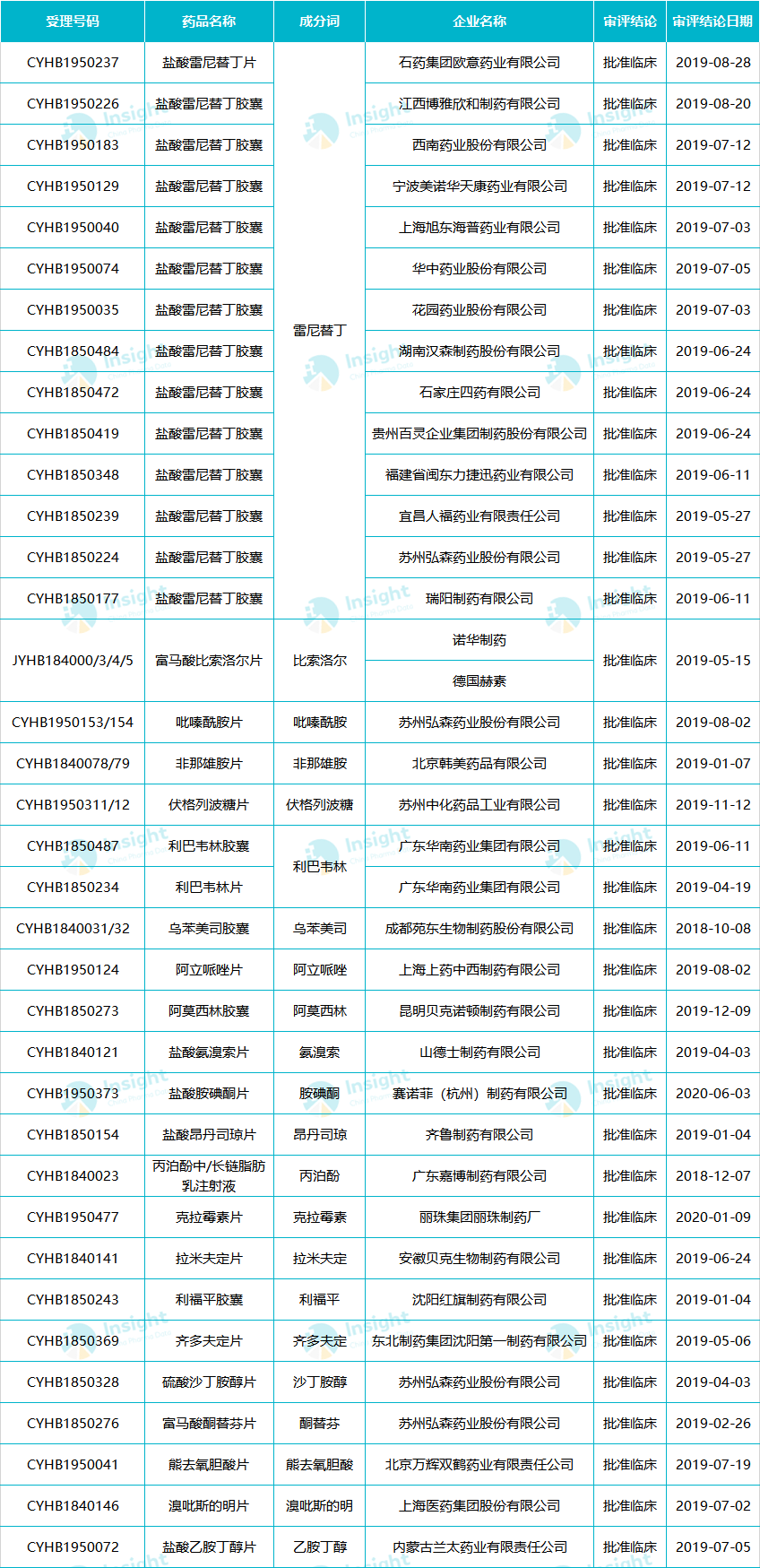
 6 个药品明确不批准一致性评价
6 个药品明确不批准一致性评价