
药品注册管理办法 上市前DSUR,上市后微小变更按年报提交。
药品生产监督管理办法 药品MAH年报交省局,疫苗MAH年报交国家局。
省局已要求年报 今年一季度已有省局要求”MAH药物警戒年报”。该省”境内MAH”及“境外MAH的境内企业法人”都要向省局提交该年报。
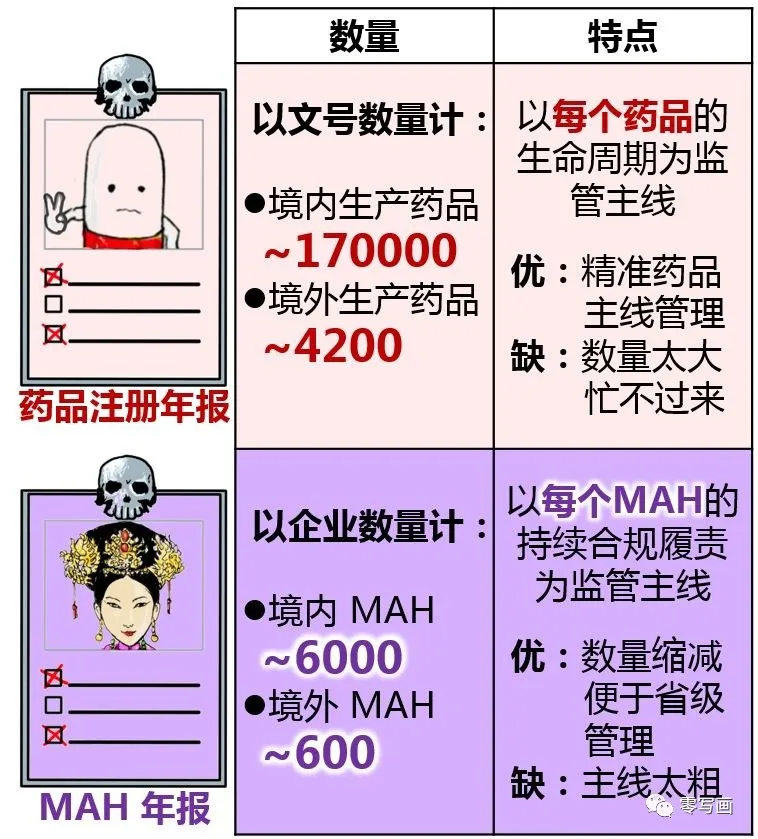
药品文号太!多!了!
以上市诞生日为周期,只适用于以药品为主线的生命周期管理。
以固定时间为周期,适合持有多品种的MAH为主线的管理。第一季度是个好选择,每年春节之后注册人员就忙着整理年报交给省局,之后省局正好在新春时节部署全年的管理计划。
变更申报资料审查 上市后注册微小变更,要按照上市后变更<指导原则>报送“申报资料”。我猜“申报资料”将作为年报附件提交。若1个MAH持有100个药品文号,附件页数会非常厚、包含变更也会非常多样,省局如何审查,审查后如何行动和处置,是个新问题。
对接和更新品种档案 品种档案包含“核准的工艺和标准”和“说明书标签”,若微小变更涉及品种档案,如何通过省局年报管理实时更新每个药品的品种档案,则又是个新问题。
跨省年报管理 集团公司可能基于各种考虑,将所持药品分配于不同省份的分公司MAH持有,相互间变更相关;或者,同一MAH的同一药品在不同省的生产厂生产(多产地);又或者,自身没有生产厂的“裸MAH”与其受托生产企业不同省,MAH与其自身生产厂不同省^诸多情况都涉及跨省问题。_省间管理若有不一致,则会大大增加企业经营的复杂度。
【编辑:amanda】 国际药物制剂网 本文链接: http://www.phexcom.cn/hydt.aspx